Chủ đề Hóa học cân bằng phương trình: Hóa học cân bằng phương trình là một trong quy trình đặc biệt quan trọng trong nghành nghề hóa học. Đây là biện pháp điều chỉnh số lượng các hóa học tham gia và sản phẩm trong một bội nghịch ứng hóa học để giành được trạng thái làm phản ứng thuận nghịch. Quá trình này giúp bảo vệ một cân bằng hoàn hảo và tuyệt vời nhất giữa những phân tử được có mặt trong cùng một thời gian. Điều này giúp đưa tin chính xác về quy trình phản ứng với là cơ sở quan trọng đặc biệt trong nhiều vận dụng hóa học.
Bạn đang xem: Cách cân bằng phương trình hóa học
Phương pháp cân bằng phương trình hóa học là quy trình điều chỉnh các hệ số phía trước những chất thâm nhập và sản phẩm trong một phản bội ứng hóa học để bảo đảm an toàn sự cân đối về nguyên tố cùng điện tích trong phản bội ứng.Dưới đó là một số cách cơ bạn dạng để cân đối phương trình hóa học:1. Xác minh các hóa học tham gia và sản phẩm trong bội phản ứng hóa học.2. Viết phương trình chất hóa học chưa thăng bằng của làm phản ứng, với những chất thâm nhập ở phía trái lốt mũi tên với các sản phẩm ở phía yêu cầu dấu mũi tên.3. Triển khai cân bằng số lượng nguyên tử cho từng nguyên tố trong làm phản ứng. Ban đầu từ những nguyên tố khác nhau, biến hóa hệ số vùng trước từng chất để gia công cho con số nguyên tử của mỗi nguyên tố bên trên cả phía 2 bên dấu mũi tên bởi nhau.4. Tiếp theo, cân bằng điện tích trong phản ứng. Phải bảo đảm an toàn tổng số năng lượng điện tích của những chất tham gia trước lốt mũi tên bởi tổng số điện tích của các sản phẩm sau vết mũi tên. Điều này hay được thực hiện bằng cách điều chỉnh số lượng ion hoặc hệ số của những phân tử không tồn tại điện tích.5. Chất vấn và làm mịn làm phản ứng cân nặng bằng. Bình chọn lại phương trình để đảm bảo rằng số lượng nguyên tử cùng điện tích đã cân bằng. Sau đó, hoàn toàn có thể sử dụng những quy tắc về viết lại phương trình để gia công mịn làm phản ứng.Lưu ý rằng khi cân đối phương trình hóa học, chỉ cần chuyển đổi số hệ số của những chất tham gia và sản phẩm, không biến hóa công thức hóa học của chúng.Hy vọng thông tin trên để giúp bạn gọi về phương pháp cân bởi phương trình hóa học.
Cân bằng phương trình chất hóa học là quá trình điều chỉnh những hệ số chất tham gia và thành phầm trong một bội nghịch ứng hóa học để đảm bảo rằng số lượng nguyên tử từng nguyên tố làm việc cả hai bên phương trình là cân bằng. Quy trình này phải tuân theo hiệ tượng bảo toàn khối lượng và bảo toàn nguyên tố, tức là cân nặng và số lượng nguyên tố không thay đổi sau khi cân nặng bằng.Để thăng bằng một phương trình hóa học, ta thực hiện công việc sau đây:1. Ghi phương trình hóa học dựa trên thông tin đã mang đến hoặc tích lũy được.2. Khẳng định số lượng nguyên tử của từng nguyên tố bên trên cả 2 bên phương trình hóa học.3. Đưa ra một dãy những hệ số không biết (thường là x) trước những chất chưa được cân bằng.4. Cân nặng bằng con số nguyên tử của những nguyên tố bên trên cả hai bên phương trình bằng phương pháp thay đổi các hệ số không biết.5. Chất vấn lại phương trình đã cân bằng bằng phương pháp đếm số lượng nguyên tử của từng nguyên tố trên cả phía 2 bên phương trình.Lưu ý rằng không đổi khác thành phần chất tham gia và sản phẩm trong quá trình cân bởi phương trình hóa học, chỉ biến hóa số lượng nguyên tử của chúng. Nếu như phản ứng tất cả điều kiện quan trọng đặc biệt (như nhiệt độ độ, áp suất, chất xúc tác), buộc phải xem xét và áp dụng thêm các yếu tố này trong quy trình cân bằng.Cân bằng phương trình hóa học là 1 trong những kỹ năng đặc trưng trong nghành nghề hóa học, góp hiểu và mô tả những quy qui định và quy trình hóa học.
Chúng ta cần cân bằng phương trình chất hóa học vì bao gồm một số nguyên nhân sau:1. Để diễn tả sự phản bội ứng chính xác: Phương trình hóa học cân đối giúp chúng ta biết đúng mực các hóa học tham gia và chất thành phầm của một phản ứng hóa học. Nếu phương trình không được cân nặng bằng, chúng ta không thể biết được tỉ lệ đúng mực của các chất tham gia với sản phẩm.2. Để vận dụng định điều khoản bảo toàn nguyên tố: cân bằng phương trình hóa học bảo đảm rằng con số nguyên tử của mỗi nguyên tố trước và sau bội nghịch ứng là bằng nhau. Điều này tuân thủ nguyên tắc bảo toàn nguyên tố, giúp bọn họ hiểu rõ hơn về thừa trình biến đổi và chuyển chất hóa học trong phản bội ứng hóa học.3. Để tính toán lượng chất cần dùng và sản phẩm thu được: bằng phương pháp cân bằng phương trình hóa học, bạn có thể xác định được tỉ lệ chính xác của những chất tham gia cùng sản phẩm. Điều này rất quan trọng đặc biệt trong việc giám sát lượng hóa học cần sử dụng và thành phầm thu được trong quá trình sản xuất với phân tích hóa học.4. Để so sánh và dự đoán phản ứng: Phương trình hóa học cân bằng cung cấp cho chúng ta thông tin quan trọng để so sánh và dự kiến sự làm phản ứng. Bạn có thể biết được một số loại hợp hóa học nào tham gia, các loại hợp chất nào sản phẩm, với tỉ lệ đúng đắn của các hợp hóa học đó. Điều này rất có ích trong việc nghiên cứu và ứng dụng các phản ứng hóa học.Tóm lại, cân đối phương trình hóa học là một trong những quá trình quan trọng giúp bọn họ hiểu rõ hơn về những phản ứng hóa học, áp dụng định chính sách bảo toàn nguyên tố và giám sát lượng chất tham gia cùng sản phẩm.

Các bước cơ bản để cân bằng phương trình hóa học là như sau:Bước 1: xác minh các hóa học tham gia và sản phẩm trong phản nghịch ứng hóa học.Bước 2: Đặt thông số trước các chất tham gia với sản phẩm làm thế nào để cho số lượng nguyên tử của các nguyên tố trùng nhau ở 2 phía của phương trình.Bước 3: cân nặng bằng con số nguyên tử từng nguyên tố một trong phương trình hóa học. Để làm cho được điều này, chúng ta có thể bắt đầu từ những nguyên tố xuất hiện trong không nhiều phân tử nhất, tiếp nối tiếp tục cân nặng bằng các nguyên tố khác.Bước 4: bình chọn lại phương trình đã cân bằng để đảm bảo số lượng nguyên tử của những nguyên tố trùng nhau đúng.Bước 5: đánh giá lại số lượng chất gia nhập và sản phẩm để đảm bảo rằng bọn chúng đã được cân nặng bằng.Lưu ý: Trong quy trình cân bằng, bạn cần xem xét các quy tắc về viết công thức hóa học cùng tính số oxi hóa. Nếu tất cả yếu tố oxi hóa, bội phản ứng rất cần phải cân bằng dựa trên số oxi hóa của những nguyên tố tham gia.Hy vọng thông tin trên đã giúp đỡ bạn hiểu về phong thái cân bởi phương trình hóa học một cách vừa đủ và đưa ra tiết.
Cân bởi phương trình chất hóa học cho học viên mới học - mất nơi bắt đầu hóa
Hóa học cân đối phương trình: Hóa học thăng bằng phương trình là 1 chủ đề lôi cuốn và đặc trưng trong nghành nghề hóa học. đoạn clip này để giúp bạn làm rõ về quy tắc cân đối phương trình và biện pháp áp dụng nó vào các bài bác tập thực tế. Hãy cùng mày mò những kín đằng sau sự cân bằng hoàn hảo!
Cân bởi phương trình chất hóa học - Hóa 8 - Thầy Đặng Xuân Chất
Thầy Đặng Xuân Chất: Thầy Đặng Xuân Chất là một trong những giảng viên hóa học năng lực và giàu tởm nghiệm. Trong video clip này, thầy chia sẻ những con kiến thức có ích về hóa học một cách đơn giản và dễ dàng hiểu. Hãy nhằm thầy Đặng Xuân hóa học dẫn dắt bạn vào thế giới tuyệt đối của hóa học!
Để cân bằng hệ số trước những chất tham gia trong bội phản ứng hóa học, chúng ta cũng có thể làm theo các bước sau:Bước 1: khẳng định các hóa học tham gia và thành phầm trong phản ứng hóa học.Bước 2: Ghi lên phương trình bội phản ứng trình bày sự biến đổi của các chất tham gia thành sản phẩm.Bước 3: Đặt hệ số cân bằng trước các chất tham gia làm thế nào cho số lượng nguyên tử của các nguyên tố trên cả hai phía của phương trình bởi nhau.Bước 4: bước đầu cân bằng từng thành phần một, ban đầu từ nguyên tố xuất hiện ít độc nhất vô nhị trong phản ứng. Thông thường, bạn cũng có thể bắt đầu tự cacbon, tiếp nối tới hidro, oxy, và những nguyên tố khác.Bước 5: Điều chỉnh hệ số cân bằng trước các chất tham gia để con số nguyên tử của nguyên tố đó trên cả nhị phía của phương trình bằng nhau.Bước 6: bình chọn lại cục bộ phương trình để bảo đảm rằng con số nguyên tử của tất cả các thành phần trên cả nhì phía đều bởi nhau.Bước 7: kiểm tra lại thăng bằng lượng điện tích bằng phương pháp kiểm tra con số ion và điện tích của chúng.Qua bài toán lặp lại các bước trên, các bạn sẽ có thể thăng bằng hệ số trước những chất tham gia trong phản nghịch ứng hóa học. Việc cân bằng phương trình hóa học này giúp bọn họ xác định đúng chuẩn tỷ lệ giữa những chất thâm nhập và sản phẩm và hiểu rõ hơn về quy chính sách bảo toàn trọng lượng và điện tích trong những phản ứng hóa học.

Để cân bằng hệ số trước những chất sản phẩm trong bội phản ứng hóa học, bạn cũng có thể tuân theo quá trình sau:Bước 1: khẳng định các hóa học tham gia và thành phầm trong làm phản ứng hóa học.Bước 2: khẳng định hệ số trước các chất thành phầm chưa cân bằng và để chúng là x.Bước 3: cân nặng bằng số lượng nguyên tử của các nguyên tố trong bội nghịch ứng bằng cách sử dụng thông số trước những chất thành phầm đã khẳng định ở cách trước đó. Các bạn cần chắc chắn là rằng số lượng các nguyên tử của mỗi nguyên tố giữ nguyên sau từng bước cân bằng.Bước 4: chất vấn lại phản bội ứng sau khi ngừng cân bởi để đảm bảo an toàn rằng con số nguyên tử của từng nguyên tố giống nhau trên cả nhị phía của bội nghịch ứng.Ví dụ: phản ứng hóa học sau đây:CH4 + O2 -> CO2 + H2OĐầu tiên, ta xác minh các chất tham gia và sản phẩm:Tham gia: CH4, O2Sản phẩm: CO2, H2OTiếp theo, ta khẳng định hệ số trước những chất thành phầm chưa cân bằng:CH4 + O2 -> x
CO2 + y
H2OSau đó, ta cân bằng con số nguyên tử của những nguyên tố trong phản nghịch ứng:Carbon (C): 1C = x
CHydrogen (H): 4H = 2y
HOxygen (O): 2O = 2x
O + y
OTiếp tục cân nặng bằng các nguyên tố:C: 1 = x
H: 4 = 2y
O: 2 = 2x + y
Từ phương trình trên, ta có thể giải hệ phương trình để tìm quý giá của x với y. Sau khi kiếm được các quý hiếm này, ta sẽ sở hữu được phương trình cân bằng hoàn chỉnh:CH4 + 2O2 -> CO2 + 2H2OCuối cùng, soát sổ lại bội phản ứng đã cân đối để bảo đảm an toàn số lượng nguyên tử của mỗi nguyên tố như thể nhau trên cả nhị phía của bội phản ứng.
Có những cách thức khác nhau để thăng bằng phương trình chất hóa học như sau:1. Phương thức đồng hệ số: Đây là phương pháp phổ phát triển thành nhất để cân bằng phương trình hóa học. Bước thứ nhất là khẳng định số liệu ban đầu, tiếp nối tìm hiểu sự thay đổi số chất tham gia và sản phẩm. Bằng phương pháp điều chỉnh hệ số phía trước các chất tham gia và thành phầm để bảo đảm số lượng nguyên tử của mỗi nguyên tố thăng bằng trên cả phía hai bên của phương trình.2. Cách thức chất điều chỉnh: cách thức này dựa trên việc thực hiện chất điều chỉnh để thăng bằng phương trình hóa học. Chất điều chỉnh thường là những chất không tham gia phản ứng nhưng hoàn toàn có thể thêm vào để kiểm soát và điều chỉnh hệ số. Bằng phương pháp sử dụng chất điều chỉnh, người ta bao gồm thể thay đổi số lượng nguyên tử của một nguyên tố nhất thiết để cân đối phương trình.3. Phương thức tăng giảm oxi-hóa: Đối với những phản ứng oxi-hóa khử, ta rất có thể sử dụng phương pháp tăng giảm oxi-hóa để cân bằng phương trình. Bằng cách điều chỉnh con số nguyên tử oxi-hóa của những chất tham gia cùng sản phẩm, ta tất cả thể bảo vệ cân bởi phương trình oxi-hóa khử.4. Phương pháp ion môi trường: Đặc biệt áp dụng cho các phản ứng ra mắt trong dung dịch, phương pháp này sử dụng các ion môi trường xung quanh (như H+, OH-, Na+, Cl-) để thăng bằng phương trình hóa học. Bằng cách điều chỉnh số lượng các ion môi trường, ta có thể đảm bảo cân bằng phương trình trong môi trường thiên nhiên dung dịch.5. Phương thức phản ứng cháy: phương pháp này dựa trên quan sát hiện tượng kỳ lạ phản ứng cháy của hóa học hữu cơ. Bằng cách cân bằng con số nguyên tử của các nguyên tố trong bước cháy, ta có thể áp dụng phương pháp này để cân bằng các phương trình hóa học tương quan đến hóa học hữu cơ.Đây là một trong những số phương thức thường được áp dụng để cân bằng phương trình hóa học. Tùy ở trong vào đặc điểm của từng phản bội ứng, người ta hoàn toàn có thể áp dụng các phương pháp này hoặc kết hợp chúng để cân bằng phương trình một cách chủ yếu xác.

3 cách cân bằng phản ứng hóa học dễ dàng - Biquyetdodaihoc
3 cách cân bằng phản ứng hóa học: chúng ta đang gặp mặt khó khăn trong việc cân bằng phản ứng hóa học? clip này để giúp đỡ bạn khám phá 3 bí quyết cân bằng tác dụng và nhanh chóng. Hãy học cách áp dụng các cách thức đúng đắn với trở thành chuyên viên về cân bằng phản ứng hóa học!
Cân thông qua số nguyên tử của những nguyên tố vào phương trình hóa học là một bước đặc biệt quan trọng trong quá trình giải phương trình hóa học. Việc thăng bằng này cần thiết vì nó giúp đảm bảo an toàn luật bảo toàn cân nặng và nguyên tử trong một phản ứng hóa học.Luật bảo toàn trọng lượng đòi hỏi trọng lượng của những chất tham gia phải bằng cân nặng của các chất sản phẩm. Khi thăng bằng số nguyên tử của các nguyên tố, ta bảo đảm rằng tổng thể nguyên tử trước và sau phản ứng không cố kỉnh đổi. Điều này là quan trọng để bảo đảm luật bảo toàn trọng lượng được tuân thủ trong làm phản ứng hóa học.Việc cân đối số nguyên tử cũng giúp khẳng định đúng công thức hóa học của những chất tham gia và sản phẩm. Khi ta biết được cách làm hóa học bao gồm xác, ta hoàn toàn có thể dễ dàng hiểu hiểu cùng diễn giải quy mô phản ứng, tấn công giá hiệu quả và quan tâm đến các yếu ớt tố tác động đến phản bội ứng.Đối với những phản ứng cháy hoặc phản bội ứng hóa học quan trọng khác, việc cân đối số nguyên tử cũng giúp xác minh đúng phần trăm phản ứng giữa hóa học tham gia cùng sản phẩm. Điều này rất đặc trưng để biết cần sử dụng bao nhiêu chất tham gia để tạo ra bao nhiêu sản phẩm mong muốn, bảo đảm kế hoạch và năng suất trong quá trình sản xuất hoặc nghiên cứu.Tóm lại, cân đối số nguyên tử của các nguyên tố trong phương trình hóa học là quan trọng để vâng lệnh luật bảo toàn khối lượng, xác minh công thức chính xác và xác suất phản ứng đúng, và hỗ trợ diễn giải với đánh giá tác dụng phản ứng.
Việc cân đối phương trình chất hóa học có ảnh hưởng đến điều kiện và năng suất phản ứng. Khi 1 phản ứng chất hóa học xảy ra, các chất gia nhập và thành phầm thường mở ra với các hệ số khác nhau trong phương trình hóa học. Cân đối phương trình chất hóa học là quá trình điều chỉnh các hệ số này để con số nguyên tử và các yếu tố khác của mỗi hóa học trong phản bội ứng cân nặng bằng.Việc cân bằng phương trình hóa học bao gồm thể ảnh hưởng đến đk phản ứng. Khi các hệ số của các chất trong phản nghịch ứng cụ đổi, tổng cộng mol của các chất cũng biến đổi theo. Điều này có thể làm biến đổi tỷ lệ mol của các chất gia nhập và sản phẩm trong phản nghịch ứng. Điều kiện phản ứng, ví dụ như nồng độ, áp suất với nhiệt độ, hoàn toàn có thể phụ nằm trong vào phần trăm mol của những chất trong bội phản ứng. Vì đó, khi thăng bằng phương trình hóa học, đk phản ứng cũng có thể thay đổi.Ngoài ra, việc cân đối phương trình hóa học cũng đều có thể ảnh hưởng đến công suất phản ứng. Hiệu suất phản ứng là một đánh giá về mức độ chấm dứt của một bội phản ứng hóa học. Lúc phản ứng không được cân bằng, những chất gia nhập và thành phầm sẽ ko tồn tại trong tỷ lệ lý tưởng, dẫn đến sự tiêu tốn lãng phí và ko hiệu quả. Bằng phương pháp cân bằng phương trình hóa học, ta bảo vệ rằng làm phản ứng diễn ra với tỷ lệ mol bao gồm xác, góp tăng công suất và đạt được kết quả mong muốn.Tóm lại, việc cân bằng phương trình hóa học không chỉ có có tác động đến đk phản ứng nhưng còn ảnh hưởng đến hiệu suất phản ứng. Quá trình này giúp điều chỉnh xác suất mol của các chất và đảm bảo an toàn phản ứng diễn ra một cách hiệu quả, đạt được hiệu quả mong muốn.
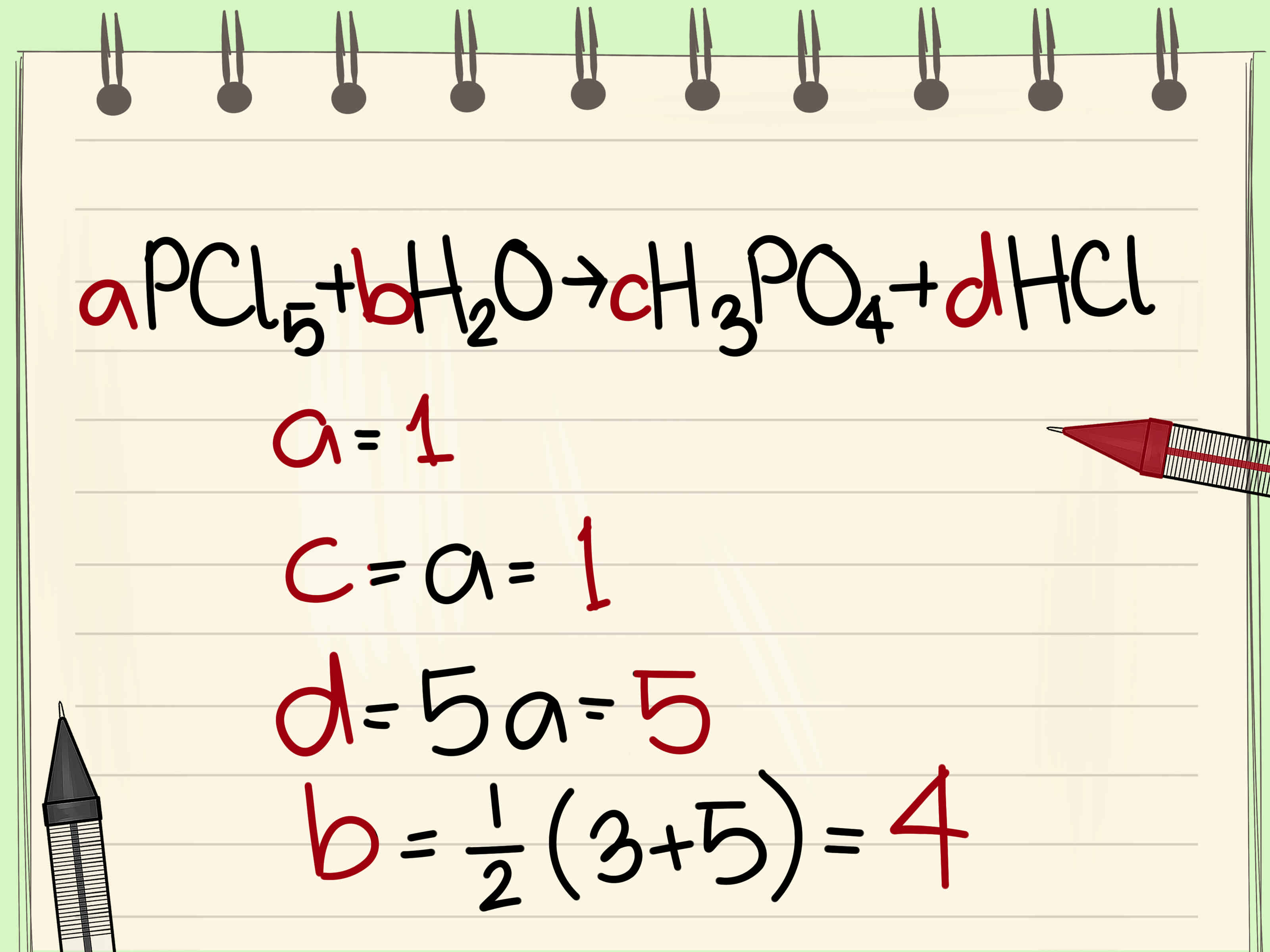
Cân bằng phương trình hóa học áp dụng trong thực tế như vậy nào?
Note: These questions cover the key aspects of balancing chemical equations, including its definition, importance, basic steps, methods, significance of balancing the number of atoms, impact on reaction conditions và efficiency, và real-world applications.
Cân bằng phương trình chất hóa học là quy trình điều chỉnh những hệ số phía trước các chất gia nhập và sản phẩm trong một bội phản ứng hóa học để đảm bảo an toàn số nguyên tử của những nguyên tố bên trên cả phía 2 bên phương trình bởi nhau. Việc cân đối phương trình chất hóa học là rất quan trọng trong hóa học vày nó chất nhận được ta tế bào tả chính xác những phản bội ứng xảy ra và đo lường số lượng hóa học tham gia và thành phầm cần thiết.Quá trình thăng bằng phương trình hóa học hay được triển khai thông qua việc biến đổi các thông số phía trước những chất, nhưng lại không biến hóa số lượng nguyên tử của các nguyên tố. Để cân đối phương trình hóa học, có một số trong những bước cơ phiên bản mà ta hoàn toàn có thể tuân theo:1. Xác định các chất tham gia và các thành phầm của làm phản ứng.2. Đếm số nguyên tử của từng nguyên tố trong những chất tham gia và sản phẩm.3. Cân đối số nguyên tử của mỗi nguyên tố bằng phương pháp thay đổi hệ số phía trước những chất.4. Soát sổ lại phương trình thăng bằng và bảo đảm an toàn số nguyên tử của những nguyên tố bên trên cả 2 bên phương trình bằng nhau.Cân bởi phương trình hóa học không những là một khía cạnh đặc biệt quan trọng trong hóa học lý thuyết, mà còn tồn tại ứng dụng trong thực tế. Ví dụ, việc cân đối phương trình chất hóa học trong quá trình sản xuất các loại chất liệu như hóa học phủ bề mặt, hóa học khử rỉ sắt, hoặc cung ứng các sản phẩm như thuốc, phân bón, và nhiều thành phầm hóa học khác.Đối với quy trình sản xuất, cân bằng phương trình hóa học rất có thể giúp xác minh số lượng hóa học tham gia và sản phẩm cần áp dụng để dành được hiệu suất cao nhất. Ko kể ra, việc cân bằng phương trình hóa học cũng quan trọng đặc biệt trong câu hỏi đảm bảo an ninh trong quy trình sản xuất và bớt thiểu những chất thải khiến hại cho môi trường.Trên thực tế, cân bằng phương trình hóa học cũng rất được sử dụng vào phân tích mẫu mã và kiểm tra chất lượng. Ví dụ, trong phân tích môi trường, việc thăng bằng phương trình hóa học hoàn toàn có thể giúp xác minh nồng độ những chất gây độc hại và đánh giá nguy cơ môi trường.
bài bác tập cân đối phương trình chất hóa học luôn mở ra trong bài xích thi giỏi nghiệp THPT đất nước hằng năm. Bài biết dưới đây sẽ cung ứng cho các em không thiếu kiến thức về phong thái cân bằng phương trình hóa học và biện pháp giải những dạng bài xích tập thăng bằng phương trình thường xuyên gặp. Các em tham khảo ngay nhé!
1. Cân bằng phương trình hóa học là gì?
Cân bằng phương trình hóa học đó là trạng thái phản ứng thuận nghịch cơ mà ở kia trong cùng thời gian có bao nhiêu những phân tử được xuất hiện từ chất lúc đầu thì sẽ sở hữu bấy nhiêu phân tử chất phản ứng cùng với nhau tạo thành chất ban đầu.
2. Cách cân đối phương trình hóa học
2.1. Cân đối phương trình hóa học bằng cách thức đại số
Bài tập thăng bằng phương trình hóa học bằng phương pháp đại số là cách thức cân bởi bằng hệ phương trình.
Bước 1: Đặt hệ số thăng bằng của chất ở bên PT là những biến chưa khẳng định a,b,c,... Ta được:
Bước 2: phụ thuộc vào tính hóa học bảo toàn nguyên tố ta có:
Fe: a mol
S: 2a mol
H: b + c mol
Cl: c mol
N: b mol
O: 3b mol
Bước 3: tiếp đến ta được phương trình và thăng bằng phương trình hóa học.
Bước 4: Ta có phương trình cân đối hoàn chỉnh.
Ví dụ:
2.2. Thăng bằng phương trình hóa học bằng phương thức chẵn - lẻ
Để thăng bằng phương trình hóa học bằng phương pháp chẵn lẻ ta thực hiện các bước sau:
Bước 1: Xét những chất trước, sau làm phản ứng để tìm nguyên tố có số nguyên tử trong một số ít CT chất hóa học là số chẵn còn làm việc CT khác là số lẻ.
Bước 2: Đặt thông số 2 trước CT tất cả nguyên tử lẻ để gia công chẵn nguyên tử của nguyên tố.
Bước 3: Tìm những hệ số còn lại để sở hữu thể xong phương trình.
Ví dụ: cân bằng phương trình hóa học sau: sắt + O2 → Fe2O3
Bước 1:
Vế trái số nguyên tử fe lẻ còn bên yêu cầu thì chẵn đề xuất nhận sắt ở vế trái lên 2. Còn oxi nghỉ ngơi vế trái thì chẵn, vế phải thì lẻ, cần ta sẽ nhân 2 mang lại số nguyên tử oxi làm việc vế phải.
2Fe + O2 → 2Fe2O3
Bước 2: Đến trên đây số nguyên tử của 2 hồ hết đã chẵn, ta chỉ cần cân bởi lại cho số nguyên tử của phía 2 bên bằng nhau.
Xem thêm: Một Số Mẹo Giải Toán Lớp 5 Và Phương Pháp Giải, 5 Bước Để Học Tốt Môn Toán Lớp 5
Bước 3: Ta gồm phương trình cân nặng bằng: 4Fe + 3O2

2.3. Thăng bằng phương trình chất hóa học bằng phương pháp thăng bằng electron
Để triển khai cân bởi phương trình hóa học bằng electron ta sẽ triển khai theo các bước sau:
Bước 1. khẳng định số oxi hoá những nguyên tố biến đổi số oxi hoá
Bước 2. Viết PT oxi hoá và quy trình khử kế tiếp cân bằng mỗi vượt trình:
+ lốt dương e bên tất cả số oxi hoá lớn.
+ Số e bằng số oxi hoá to trừ số oxi hoá bé.
+ Nhân cả quá trình với chỉ số nguyên tố biến đổi số oxi hoá.
Bước 3.Tìm hệ số thích hợp để có tổng số e cho ngay số e nhận:
+ tìm bội chung nhỏ dại nhất của e nhường, nhận.
+ mang bội chung bé dại nhất phân tách e ngơi nghỉ từng quy trình tìm hệ số.
Bước 4. Đặt thông số chất oxi hoá, hóa học khử vào sơ vật dụng phản ứng tiếp đến kiểm tra lại.
Ví dụ: cân đối phương trình sau: p. + O2 → P2O5
2.4. Cân bằng phương trình hóa học theo yếu tắc tiêu biểu
Cách cân bằng phương trình hóa học đơn giản dễ dàng nhất thăng bằng theo nguyên tố vượt trội và thức hiện qua 3 bước:
Bước 1: chọn nguyên tố tiêu biểu.
Bước 2: Thực hiện thăng bằng nguyên tố tiêu biểu.
Bước 3: cân đối nguyên tố không giống theo thành phần ban đầu.
Ví dụ: thăng bằng phản ứng KMn
O4 + HCl → KCl + Mn
Cl2 + Cl2 + H2O
Bước 1: lựa chọn nguyên tố tiêu biểu: O
Bước 2: cân bằng nguyên tố tiêu biểu: KMn
O4 –> 4H2O
Bước 3: Tiếp tục triển khai cân bằng những nguyên tố khác:
+ Theo yếu tắc H: 4H2O → 8HCl
+ Theo nhân tố Cl: 8HCl → KCl + Mn
Cl2 + 5/2 Cl2
Ta có:
KMn
O4 + 8HCl → KCl + Mn
Cl2 + 52Cl2 + 4H2O
Nhân tất cả hệ số với mẫu số thông thường ta được:
2KMn
O4 + 16HCl → 2KCl + 2Mn
CL2 + $frac52$CL2 + 8H2O2
2.5. Thăng bằng phương trình hóa học dựa vào nguyên tố chung nhất
Là việc lựa chọn nguyên tố có đựng được nhiều hợp hóa học nhất trong bội nghịch ứng để bắt đầu cân bằng các phân tử.
Ví dụ: Cu + HNO3 → Cu(NO3)2 + NO + H2O
Nguyên tố oxi xuất hiện nhiều nhất, vế trái có 3 nguyên tử, vế phải gồm 8. Bội số chung nhỏ tuổi nhất của 8,3 là 24, suy ra thông số HNO3 là 24/3 = 8
8HNO3 → 4H2O → 2NO
3Cu(NO3)2 –> 3Cu
PT được cân bằng là:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
2.6. Cân bằng phương trình hóa học theo bội phản ứng cháy hóa học hữu cơ
a. Bội nghịch ứng cháy của hidrocacbon:
Thực hiện cân bằng phương trình hóa học hữu cơ theo trình từ bỏ sau:
- thăng bằng H ta lấy số nguyên tử H của hidrocacbon phân tách 2, nếu ra hiệu quả kẻ thì nhân với phân tử hidrocacbon, nếu chẵn nhằm nguyên.
- thăng bằng nguyên tử C.
- cân bằng nguyên tử O.
b. Bội nghịch ứng cháy khi vừa lòng chất cất O.
- cân bằng theo công việc sau:
- thăng bằng nguyên tử C.
- cân bằng nguyên tử H.
- thăng bằng nguyên tử O bằng phương pháp tính ra số nguyên tử O làm việc vế phải sau đó trừ đi số nguyên tử O trong vừa lòng chất. Công dụng thu được thì phân chia đôi để ra hệ số của O2. Nếu thông số lẻ thì nhân song hai vế PT rồi khử mẫu.
Đăng ký ngay nhằm được những thầy cô ôn tập và tạo lộ trình học tập tập
THPT vững vàng vàng
3. Những dạng bài tập cân đối phương trình hóa học
3.1. Bài tập thăng bằng phương trình hóa học
Ví dụ: cân nặng bằng những phương trình chất hóa học sau:
Giải:
Ta có các phương trình cân nặng bằng:
3.2. Bài bác tập lập sơ đồ dùng nguyên tử và tìm số phân tử mỗi hóa học sau phản bội ứng hóa học
Ví dụ: Lập sơ thứ nguyên tử với tìm số phân tử từng chất trong các phương trình sau:
Giải:
a) 4Na + O2 → 2Na2O
Tỉ lệ nguyên tố na : yếu tố O2 : số phân tử Na2O = 4 : 1 : 2
b) P2O5 + 3H2O → 2H3PO4
Tỉ lệ thành phần P2O5: phân tử H2O : phân tử H3PO4 = 1 : 3 : 2
c) 2Hg
O → 2Hg + O2
Tỉ lệ nhân tố Hg
O : nguyên tử Hg : phân tử O2 = 2 : 2 : 1
d) 2Fe(OH)3 → Fe2O3 + 3H2O
Tỉ lệ phân tử Fe(OH)3 : phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3
3.3. Bài xích tập PTHH hợp hóa học hữu cơ
Ví dụ: cân bằng các phương trình sau đây:
Giải:
Ta cân bằng các phương trình sau:
3.4. Bài xích tập cân bằng phương trình hóa học chứa ẩn
Ví dụ:
Giải:
3.5. Bài xích tập chọn thông số và bí quyết hóa học phù hợp điền vào dấu hỏi chấm
Ví dụ:
4. Bài tập trường đoản cú luyện cân bằng phương trình hóa học
Bài tập 1: cân bằng những phương trình chất hóa học sau:
Giải:
Bài tập 2: Lập sơ vật nguyên tử với tìm số phân tử mỗi chất trong các phương trình sau:








