Tài liệu Giáo viên
Lớp 2Lớp 2 - liên kết tri thức
Lớp 2 - Chân trời sáng tạo
Lớp 2 - Cánh diều
Tài liệu Giáo viên
Lớp 3Lớp 3 - kết nối tri thức
Lớp 3 - Chân trời sáng tạo
Lớp 3 - Cánh diều
Tài liệu Giáo viên
Tài liệu Giáo viên
Lớp 4Lớp 4 - kết nối tri thức
Lớp 4 - Chân trời sáng sủa tạo
Lớp 4 - Cánh diều
Tiếng Anh lớp 4
Tài liệu Giáo viên
Lớp 5Sách giáo khoa
Sách/Vở bài xích tập
Tài liệu Giáo viên
Lớp 6Lớp 6 - liên kết tri thức
Lớp 6 - Chân trời sáng tạo
Lớp 6 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 7Lớp 7 - liên kết tri thức
Lớp 7 - Chân trời sáng tạo
Lớp 7 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 8Lớp 8 - kết nối tri thức
Lớp 8 - Chân trời sáng sủa tạo
Lớp 8 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 9Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 10Lớp 10 - liên kết tri thức
Lớp 10 - Chân trời sáng sủa tạo
Lớp 10 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 11Lớp 11 - kết nối tri thức
Lớp 11 - Chân trời sáng tạo
Lớp 11 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 12Sách giáo khoa
Sách/Vở bài bác tập
Tài liệu Giáo viên
thầy giáoLớp 1
Lớp 2
Lớp 3
Lớp 4
Lớp 5
Lớp 6
Lớp 7
Lớp 8
Lớp 9
Lớp 10
Lớp 11
Lớp 12

Công thức hóa học 12Chương 1: Este – Lipit
Chương 2: Cacbohiđrat
Chương 3: Amin, amino axit với protein
Chương 4: Polime và vật liệu polime
Chương 5: Đại cương cứng về kim loại
Chương 6: kim loại kiềm, sắt kẽm kim loại kiềm thổ, nhôm
Chương 7: fe và một số trong những kim loại quan trọng
Trọn bộ công thức Hóa học lớp 12 học tập kì 1, học kì 2 quan trọng sẽ giúp học sinh nắm vững công thức, dễ ợt tổng kết lại kiến thức và kỹ năng đã học từ đó bài bản ôn tập hiệu quả để đạt tác dụng cao trong các bài thi môn hóa học 12.
Bạn đang xem: Các công thức hóa học quan trọng
Trọn bộ công thức Hóa học lớp 12 học tập kì 1, học kì 2 quan tiền trọng
Chương 1: Este – Lipit
Chương 2: Cacbohiđrat
Chương 3: Amin, amino axit và protein
Chương 4: Polime và vật liệu polime
Chương 5: Đại cương cứng về kim loại
Chương 6: kim loại kiềm, kim loại kiềm thổ, nhôm
Chương 7: fe và một trong những kim các loại quan trọng
Chương 1: Este – Lipit
Công thức tính hiệu suất phản ứng este hóa xuất xắc nhất
Phản ứng este hóa là bội phản ứng thuận nghịch (xảy ra không trả toàn) bắt buộc thường đi kèm theo với năng suất phản ứng. Phương pháp tính hiệu suất phản ứng este hóa như vậy nào? bài viết dưới đây sẽ giúp đỡ các em học xuất sắc dạng bài này.
1. Công thức tính hiệu suất phản ứng este hóa
Phương trình bội nghịch ứng pha chế este 1-1 chức từ axit cacboxylic 1-1 chức với ancol đối chọi chức tất cả dạng:

Trong đó: R là nơi bắt đầu hiđrocacbon,
R’ là nơi bắt đầu hiđrocacbon, R’ ≠ H
Theo phương trình:
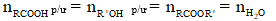
- Tính công suất theo hóa học phản ứng (tính theo chất có công dụng phản ứng hết)

- Tính hiệu suất theo hóa học sản phẩm:

- Áp dụng định hình thức bảo toàn khối lượng:

Ví dụ:Đun 12 gam axit axetic cùng với 13,8 gam etanol (có H2SO4 đặc làm cho xúc tác) đến khi phản ứng đạt tới mức trạng thái cân nặng bằng, thu được 11 gam este. Năng suất của phản nghịch ứng este hóa là
A. 1/2
B. 62,5%
C. 55%
D. 75%
Hướng dẫn giải


→ Đáp án B.
2. Bạn nên biết
Nếu đề bài bác cho công suất (H%) yêu mong tính m, V,...
Bước 1: Tính m, V,... (theo phương trình).
Bước 2: Áp dụng nguyên tắc phải nhân – trái chia
+ ví như m, V của thành phầm (bên phải) thì nhân tác dụng ở cách 1 cùng với hiệu suất.

+ ví như m, V,... Của chất phản ứng (bến trái) thì chia hiệu quả ở bước 1 cho hiệu suất.

3. Kỹ năng mở rộng
Điều chế este nhiều chức

Trong đó: R là gốc hiđrocacbon,
R’ là gốc hiđrocacbon, R’ ≠ H
n, m theo thứ tự là số chức axit, ancol.
Xét tỉ lệ:

Chú ý:
- Tính theo phương trình hóa học buộc phải tính theo chất có công dụng phản ứng hết.
- làm phản ứng este hóa là làm phản ứng thuận nghịch (phản ứng không hoàn toàn).
4. Bài tập minh họa
Câu1:Cho ancol etylic tác dụng với axit axetic thì chiếm được 22,0 gam este, H = 25%. Cân nặng ancol phản ứng là
A.26,0 gam. B.46,0 gam. C.92,0 gam. D.11,5 gam
Hướng dẫn giải

→Đáp án B
Câu2: Cho0,1molglixerol(C3H5(OH)3)phản ứng với0,15molaxitacrylic(CH2 =CHCOOH)có
H2SO4 đặcvớihiệu suấtlà60%thuđượcmgameste X. Giátrịcủa mlà:
A.7,62g B.15,24g C.21,167g D.9,62g
Hướng dẫn giải

→ axit có công dụng hết.
Theo phương trình n este lý thuyết= n axit = 0,05 mol
→ n este thực tế = 0,6.0,05 = 0,03 mol
→ m este thực tế= 254.0,03 = 7,62 gam
→ Đáp án A
Công thức phản ứng xà phòng hóa este tuyệt nhất
Bài tập về làm phản ứng xà chống hóa este rất thông dụng trong những đề thi, đề kiểm tra. Nó cũng chiếm đa số số lượng so với những dạng bài tập khác cùng trải gần như ở những mức độ (thông phát âm - áp dụng - vận dụng cao). Bài viết này để giúp các em nắm vững và thật tự tin khi giải các bài tập thủy phân este.
1. Công thức giải vấn đề phản ứng xà chống hóa este
a) Xà phòng hóa este 1-1 chức, mạch hở
- Tổng quát:

→n
RCOOR’p/ư= n
Na
OHp/ư = n
RCOONa = n
R’OH
- một số công thức áp dụng:
+Theo định phương pháp bảo toàn khối lượng: meste + m
Na
OH = mmuối rắn+m
R’OH
+ Theođịnh mức sử dụng bảo toàn nguyên tố:
n
OH(Na
OH)= n
OH(R’OH); n
Na(Na
OH)= n
Na(RCOONa)
b) Xà phòng hóa este đa chức
- Este tạo nên thành tự axit đối kháng chức cùng ancol nhiều chức (n chức): (RCOO)n
R’

- Este tạo nên từ ancol và axit tất cả

+ n-COO- = n
Na
OH
+ meste + m
Na
OHpư = mmuối rắn+ mancol
c) Xà phòng hóa este của phenol
Tổng quát:
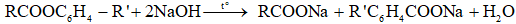
→ trường hợp phản ứng vừa đủ:

- Định luật pháp bảo toàn khối lượng: meste + m
Na
OHpư = mmuối rắn+ m
H2O
- tất cả hổn hợp este đối kháng chức có
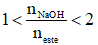
Ví dụ:Cho 0,1 mol một este X tác dụng vừa đầy đủ với dung dịch đựng 0,2 mol Na
OH, thu được tất cả hổn hợp hai muối của nhì axit hữu cơ đều đối kháng chức cùng 6,2 g một ancol Y. Y là
A.propan-1,3-điol. B.butan-1-ol.
C.propan-1-ol giỏi propan-2-ol. D.etilenglicol.
Hướng dẫn giải
Theo đề bài xích sau bội nghịch ứng thu được các thành phần hỗn hợp hai muối của nhị axit hữu cơ đều solo chức với ancol; lại sở hữu
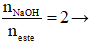
→ nacol = neste = 0,1 mol
→ Mancol=

→ ancol Y là C2H4(OH)2 etylenglicol
→ Đáp án D
2. Bạn nên biết:
- Cô cạn dung dịch sau bội nghịch ứng được chất rắn khan, chú ý đến lượng Na
OH còn dư xuất xắc không.
mrắn khan = mmuối+ m
Na
OH (nếu có)
3. Kiến thức và kỹ năng mở rộng
Este sinh sản thành tự axit đa chức (n chức) và ancol đa chức (m chức):

nmuối = (số chức ancol).neste
nancol = (số chức axit).neste
n-COO- = n
Na
OH= (số chức ancol).(số chức axit).neste
4. Bài tập minh họa
Câu 1: Thuỷ phân hoàn toàn 0,2 mol một este E cần dùng vừa đủ 100 gam dung dịch Na
OH 24%, thu được một ancol và 43,6 gam hỗn hợp muối của nhì axit cacboxylic 1-1 chức. Nhì axit đó là
A. HCOOH và CH3COOH
B. CH3COOH và C2H5COOH
C. C2H5COOH và C3H7COOH
D. C3H7COOH và C4H9COOH
Hướng dẫn giải
n
Na
OH = 0,6 mol
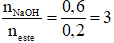
Kết hòa hợp đề bài → este 3 chức tạo vì chưng axit cacboxylic 1-1 chức với ancol 3 chức
→ n muối hạt = n Na
OH = 0,6 mol
Gọi cách làm chung của nhị muối là


→

→ 2 muối bột HCOONa và CH3COONa thỏa mãn
→ Đáp án A
Câu 2:Cho 0,1 mol phenyl axetat chức năng hết với 300 ml hỗn hợp Na
OH 1M. Xong xuôi phản ứng, cô cạn hỗn hợp thì trọng lượng chất rắn khan thu được là
A.16,2 gam.
B.22,0 gam.
C.19,8 gam.
D.23,8 gam.
Hướng dẫn giải
n
Na
OH= 0,3 mol

Áp dụng định luật bảo toàn khối lượng:
meste + m
Na
OH = mrắn+ m
H2O
136.0,1 + 40.0,3 = m rắn + 18.0,1
→ m rắn= 23,8 gam
→ Đáp án D
Công thức bội phản ứng xà phòng hóa chất lớn hay nhất
Bài tập về phản bội ứng thủy phân chất béo trong môi trường xung quanh kiềm (phản ứng xà phòng hóa) là dạng bài xích tập giữa trung tâm về hóa học béo, mặc dù nhiều em học sinh vẫn còn lo sợ khi chạm mặt phải dạng bài này.Bài viết bên dưới đây sẽ giúp đỡ các em tất cả cái nhìn tổng quan hơn về dạng bài tập, đồng thờicung cấp cho cácphương pháp giải nhanhđể những em rất có thể giải quyết dạng bài xích tập này một cách dễ dàng nhất.
1. Công thức câu hỏi phản ứng xà phòng hóa chất béo
Phương trình bội nghịch ứng thủy phân chất béo trong môi trường kiềm (phản ứng xà phòng hóa)

- Theo phương trình ta có:

- Áp dụng định hình thức bảo toàn khối lượng:
m chất béo+ m
Na
OH = mmuối + mglixerol
Lưu ý: Mglixerol = 92 (g/mol)
Ví dụ: Xà phòng hóa hoàn toàn m gam tristearin đề nghị vừa đầy đủ 300 ml dung dịch Na
OH 0,2 M. Quý giá của m là
A.17,68. B.17,80. C.53,40. D.53,04
Hướng dẫn giải
n
Na
OH= 0,3.0,2 = 0,06 mol

Tristearin:(C17H35COO)3C3H5(M=890 g/mol)
→ m tristearin = 890.0,02 = 17,8 gam
→ Đáp án B
2. Bạn nên biết
Một số axit mập và triglixerit(chất béo)tương ứng với các axit bự đó:
Tên axit béo | CTPT axit béo | Tên triglixerit tương ứng | CTPT triglixerit tương ứng | Đặc điểm cấu tạo |
Axit panmitic | C15H31COOH (M = 256) | Tripanmitin | (C15H31COO)3C3H5 (M = 806) | No |
Axit stearic | C17H35COOH (M = 284) | Tristearin | (C17H35COO)3C3H5 (M = 890) | No |
Axit oleic | C17H33COOH (M = 282) | Triolein | (C17H33COO)3C3H5 (M = 884) | Không no |
Axitlinoleic | C17H31COOH (M = 280) | Trilinolein | (C17H31COO)3C3H5 (M = 878) | Không no |
4. Bài bác tập minh họa
Câu 1: Xà chống hoá trọn vẹn 35,6 gam chất mập X đề xuất vừa đủ dung dịch chứa 0,12 mol Na
OH. Cô cạn hỗn hợp sau phản nghịch ứng, thu được m gam muối. Quý giá của m là
A.38,08. B.29,36. C.36,72. D.38,24.
Hướng dẫn giải

→ m glixerol = 0,04.92 = 3,68 gam
Áp dụng định pháp luật bảo toàn khối lượng
m hóa học béo+ m Na
OHp/ư = m muối + m glixerol
35,6 + 0,12.40 = m + 3,68
→ m = 36,72 gam
→ Đáp án C
Câu 2: Xà chống hóa hoàn toàn trieste X bằng dung dịch Na
OH thì chiếm được 9,2 gam glixerol với 83,4 gam muối hạt của axit khủng B. Tên của B là
A. axit axetic. B. axit pamitic. C. Xem thêm: Học Ngành Tâm Lý Học Rmit 'Bắc Tiến' Ngành Tâm Lý Học Và Hàng Không
Hướng dẫn giải
n glixerol= 0,1 mol
→ n xà chống = 3.n glixerol = 3.0,1 = 0,3 mol

→C15H31COONa
→ Axit bự B làaxitpanmitic
C15H31COOH
→ Đáp án B
Công thức câu hỏi đốt cháy este hay nhất
Bài toán đốt cháy este là một trong trong các dạng bài tập đặc trưng của este.Để làm xuất sắc bài toán đốt cháy estehọc sinhcần nắm rõ mối tương tác về thành phầm cháy và áp dụng linh hoạt các định lý lẽ bảo toàn. Nội dung bài viết dưới đây tổng hợp toàn bộ các công thức giúpcácemhọc sinh có thểlàm xuất sắc dạng bài tập này.
1. Những công thức giải bài toán đốt cháy este
Gọi cách làm phân tử tổng quát củaeste là
Cn
H2n+2-2k
O2x(n ≥ 2)
Trong đó: n là số nguyên tử cacbon vào phân tửeste
k là độ bất bão hòa trong phân tử este
x là số nhóm chức – COO -
Suy ra công thứcesteno, đối kháng chức, mạch hở là Cn
H2n
O2 (n ≥ 2)
- Đối cùng với este no, 1-1 chức, mạch hở:Cn
H2n
O2(n ≥ 2)

- Đối với este không no, đối kháng chức, một liên kết đôi C=C mạch hở:Cn
H2n
O2

- Đối với este no, hai chức, mạch hở:

- Đối với este mạch hở bất kì, gồm độ bất bão hòa toàn phân tử là k (k gồm cả links π ở đội chức và ở cội hiđrocacbon)
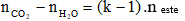
Ngoài ra, khi giải bài xích tập đốt cháy este cần phối kết hợp các định phép tắc bảo toàn trọng lượng và bảo toàn nguyên tố:
- Bảo toàn nguyên tố:

- Bảo toàn khối lượng:

Ví dụ: X là các thành phần hỗn hợp 2 este đơn chức ko no có một nối song trong nơi bắt đầu hiđrocacbon, liên tục trong hàng đồng đẳng. Đốt cháy hoàn toàn m gam X được 1,4 mol CO2 với 1,1 mol H2O. Bí quyết phân tử 2 este là
A. C4H6O2 và C5H8O2.
B. C4H4O2 và C5H6O2.
C. C3H4O2 với C4H6O2.
D. C3H2O2 cùng C4H4O2.
Hướng dẫn giải
Este đối kháng chức, không no có một nối song C=C cháy


Hai este tiếp tục trong dãy đồng đẳng → C4H6O2 cùng C5H8O2
→ Đáp án A
2. Bạn nên biết
- phản nghịch ứng đốt cháy este no, solo chức, mạch hở

- phản nghịch ứng đốt cháy este không no, đơn chức, một liên kết đôi C=C mạch hở hoặc este no, nhì chức, mạch hở

- phản nghịch ứng bao quát đốt cháy este.

3. Kiến thức mở rộng
Xử lý sản phẩm cháy
Dẫn thành phầm cháy trải qua dung dịch kiềm
+ nếu như Ba(OH)2/Ca(OH)2 dư:


4. Bài bác tập minh họa
Câu 1: Đốt cháy hoàn toàn một tất cả hổn hợp gồm các este đơn chức, no, mạch hở. Hấp thụ cục bộ sản phẩm cháy vào bình đựng hỗn hợp Ca(OH)2 dư, thấy cân nặng bình tăng thêm 24,8 gam với thu được m gam kết tủa. Quý giá của m là
A. 40,0. B. 24,8. C. 20,0. D. 49,6
Hướng dẫn giải
Gọi bí quyết phân tử của este no, đơn chức, mạch hở là Cn
H2n
O2 (n ≥ 2)

→ Đáp án A
Câu 2:Đốt cháy hoàn toàn m gam hỗn hợp hai este no, 1-1 chức, mạch hở yêu cầu dùng vừa đủ 15,12 lít khí O2 (đktc), sau phản bội ứng thu được 24,2 gam khí CO2. Quý giá của m là
A. 43,1
B. 12,5
C. 4,9
D. 21,5
Hướng dẫn giải

Este no, 1-1 chức, mạch hở

Áp dụng định phép tắc bảo toàn cân nặng
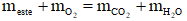
→ m + 32. 0,675 = 44.0,55 + 18.0,55
→ m = 12,5 gam
→ Đáp án B
Công thức bài toán đốt cháy chất bự hay nhất
Bài toán đốt cháy chất lớn là trong những dạng toán đặc thù của chất béo.Bài viết sau đây đưa ra những công thức đểgiúp các em học tập sinhgiải bài toán đốt cháy chất béomột cách mau lẹ và chính xác, lấy lại tác dụng cao trong học tập.
1. Cách làm giải việc đốt cháy chất béo
Gọi bí quyết phân tử phổ biến của chất béo là: Cn
H2n+2-2k
O6
Trong đó: k là độ bất bão hòa trong phân tử chất to (gồm cả link π ở team chức và gốc hiđrocacbon) (k ≥ 3)

- bí quyết tính số mol hóa học béo:

- Áp dụng định chế độ bảo toàn trọng lượng cho bội nghịch ứng cháy:

- Áp dụng định khí cụ bảo toàn nguyên tố:

+) Số nguyên tử C trong vừa lòng chất phệ

Ví dụ:Hỗn đúng theo X bao gồm 2 triglixerit no. Đốt cháy hoàn toàn m gam X nên V lít oxi (đktc) chiếm được 34,272 lít CO2 (đktc) và 26,46 gam H2O. Giá trị của V là
A.48,720.
B.49,392.
C.49,840.
D.47,152.
Hướng dẫn giải:

Triglixerit no → trong phân tử cất 3 liên kết π
→ k = 3
Áp dụng công thức

n
O (trong chất béo)= 6.n
CB = 6.0,03 = 0,18 mol
Bảo toàn yếu tố O

→ Đáp án A
2. Bạn nên biết:
- cách làm tính độ bất bão hòa k dựa vào CTPT của hợp hóa học hữu cơ đựng C, H, O

Trong đó:
C là số Cacbon gồm trong hợp hóa học hữu cơ
H là số H tất cả trong hợp chất hữu cơ.
-Chất béo (hay nói một cách khác triglixerit xuất xắc triaxylglixerol): là trieste của glixerol với các axit béo.
- Glixerol (hoặc glixerin): C3H5(OH)3 (M = 92 g/mol)
3. Kiến thức mở rộng
-Bài toán đốt cháy chất phệ thường đi kèm với thủy phân chất to hoặc cộng H2; Br2 vào nơi bắt đầu không no.
- việc phụ mang đến chất lớn không no phản nghịch ứng với dung dịch Br2 hoặc hiđro hóa (Ni, to)

- việc phụ đến chất béo phản ứng với hỗn hợp Na
OH (phản ứng xà phòng hóa).

4. Bài bác tập minh họa
Câu 1: Đốt cháy hoàn toàn 0,1 mol triglixetit ta thu được 250,8 gam CO2 với 90 gam H2O. Mặt khác 0,1 mol X bội phản ứng toàn diện với V lít hỗn hợp Br2 1M. Giá trị của V là
A. 0,7 B. 0,3 C. 0,5 D. 0,4
Hướng dẫn giải:

Áp dụng công thức:

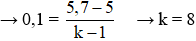
→ tất cả 8 links π trong những số ấy 3π trong nhóm chức -COO- cùng 5π vào C=C
→n
Br2 = 5.n
CB= 5.0,1 = 0,5 mol
→ Đáp án C.
Câu 2: Đốt cháy trọn vẹn 17,72g một chất béo nên 1,61 mol O2 chiếm được CO2và 1,06 mol H2O. Khía cạnh khác mang lại 26,58 gam chất béo này vào toàn vẹn dung dịch Na
OH thì thu được lượng muối hạt là
Fundamentals and Applications of Microfluidics
Tieng Viet Vietnamese for Beginners 1Intercultural communication

I. DÃY ĐIỆN HÓATính Oxi hóa của Cation kim loại tăng dần
K+ Ba2+ Ca2+ Na+ Mg2+ Al3+ Cr2+ Zn2+ Cr3+ Fe2+ Ni2+ Sn2+ Pb2+ 2H+ Cu2+ Fe3+ Ag+ Hg2+ Pt2+ Au3+
K cha Ca mãng cầu Mg Al Cr Zn Cr2+ fe Ni Sn Pb H 2 Cu Fe2+ Ag Hg Pt Au Tính khử của kim loại giảm dần
II. MỘT SỐ CÔNG THỨC HÓA HỌC CẦN NHỚ*Mối quan hệ giữa số mol(n) thể tích dd (Vdd) với nồng độ mol CM
dd
M ct
VC n (M) →n cm Vdd (mol) →M
dd CV n (lít)Mối dục tình giữa số mol(n), khối lƣợng (m) cùng khối lƣợng Mol(M):Mn m (mol) m = n. M (gam)Mối quan hệ nam nữ giữa số mol khí với thể tích khí sinh sống đktcV = n. 22,4 (lít) →
22 4,n V (mol)* Số trieste sản xuất từ n axit cùng Glixerol =
2n 2 n 1 VD: 2 axit thì có 6
2222 1 triesteIII. MỘT SỐ CÔNG THỨC TÍNH cấp tốc SỐ ĐỒNG PHÂN
***** Số đồng phân axit cacboxylict đơn chức no Cn
H2n
O 2 :
Công thức: VD: C 4 H 8 O 2 = 24-3 = 2 1 = 2
***** Số đồng phân este 1-1 chức no Cn
H2n
O 2 :
Công thức: VD: C 4 H 8 O 2 = 24-2 = 2 2 = 4
***** Số đồng phân amin đơn chức no Cn
H2n+3N:
Công thức: VD: C 3 H 9 N = 23-1 = 2 2 = 4
***** Số đồng phân amin bậc 1 solo chức no Cn
H2n+3N:
Công thức: VD: VD: C 3 H 9 N = 23-2 = 2 1 = 2
IV. MỘT SỐ LÝ THUYẾT HỮU CƠ. VÔ CƠ CẦN NHỚ:CHƢƠNG 1. I. ESTE : R COOnm nm
R,
**+ HCOOCH 3 : metyl fomat
HCOOC 2 H 5 : etyl fomatHCOOCH 2 CH 2 CH 3 : propyl fomat
CH 3 COOCH 3 : Metyl axetat
CH 3 COOC 2 H 5 : Etyl axetat
C 6 H 5 COOCH 3 : Metyl benzoat**
**+ CH 3 COOCH=CH 2 : Vinyl axetat
CH 2 =CHCOOCH 3 : Metyl acrylatC 6 H 5 COOCH 3 : Metyl benzoat
CH 3 COOCH 2 C 6 H 5 : Benzyl axetat
C 17 H 35 COOCH 3 : Metyl stearat
C 15 H 31 COOCH 3 : Metyl panmitat
CH 3 COOCH 2 CH 2 CH(CH 3 ) 2 : isoamyl axetat (mùi dầuchuối)**Số axit Cn
H2n
O 2 = 2n-3 (n
Số este Cn
H2n
O 2 = 2n-2 (n
Số amin Cn
H2n+3N = 2n-1 (n
Số amin Cn
H2n+3N = 2n-2 (1TÀI LIỆU ÔN THI TỐT NGHIỆP thpt MÔN HÓA
II. LIPIT(chất béo):(RCOO) 3 C 3 H 5 : là este của axit lớn với
**glixerol(C 3 H 5 (OH) 3 )
Tripanmitin (rắn): (C 15 H 31 COO) 3 C 3 H 5Tristearin ( rắn ): (C 17 H 35 COO) 3 C 3 H 5****+ Trilinolein ( lỏng ):(C 17 H 31 COO) 3 C 3 H 5
Triolein ( lỏng ):(C 17 H 33 COO) 3 C 3 H 5**CHƢƠNG 2. CACBOHIDRAT: Cn(H 2 O)m: là phù hợp chất
**hữu cơ tạp chức
Monosaccarit: C 6 H 12 O 6 : glucozo, fructozo(M = 180)
Đisaccarit: C 12 H 22 O 11 : Saccarozo, Mantozo(M = 342)
Polisaccarit:(C 6 H 10 O 5 )n:Tinh bột, xenlulozo
CH 2 OH(CHOH) 4 CH 2 OH: Sobitol
Một số hóa học bị thủy phân trong môi trƣờngaxit(H+): Saccarozo, mantozo, tinh bột, xenlulozo.
Một số chất không bị thủy phân vào môitrƣờng axit: Glucozo, Fructozo.
Một số hóa học hòa chảy đƣợc Cu(OH) 2 sống đk thƣờngtạo phức greed color lam: glucozo, Fructozo,Saccarozo, mantozo, glixerol(C 3 H 5 (OH) 3 ).
Một số chất tham gia làm phản ứng tránggƣơng(tráng bạc , Ag
NO 3 /NH 3 ): glucozo,fructozo, mantozo, HCHO, HCOOH, HCOOR.
Tinh bột, xen lulozo, mantozo thủy phân trongmôi trƣờng axit tạo nên Glucozo.
CHƢƠNG 3. I. AMIN:
+
CH 3 -N-CH 3
CH 3 : Trimetyl amin(bậc 3)
CH 3 – NH 2 : Metyl amin (bậc 1)+ CH 3 -NH-CH 3 : Đimetyl amin (bậc 2)CH 3 – NH – C 2 H 5 : N- Etylmetan amin (hoặcetyl, metyl amin)( bậc 2 )C 2 H 5 -NH 2 : Etylamin( bậc 1)C 6 H 5 -NH 2 : Anilin( bậc 1)II. AMINOAXIT: (H 2 N)x-R-(COOH)y
+ Axit amino axetic hoặc Glyxin (Gly): H 2 N−CH 2 −COOH (M = 75)
+ Axit - amino Glutaric hoặcAxit Glutamic(Glu):
HOOC - CH2-CH2-CH - COOHNH+ Axit - amino propylonic hoặc Alanin (Ala):####### CH 3 CH
####### NH 2
####### COOH H 2 N CH 2
####### NH 2
####### COOH
####### alanin lysin
(M = 89)
Các aminoaxit đầy đủ là hóa học lƣỡng tính → vừa tácdụng cùng với axit(HCl), vừa tác dụng với bazo(NaOH,KOH).Các amin CH 3 NH 2 , C 2 H 5 NH 2 , CH 3 NHCH 3 , ...phản ứng đƣợc cùng với dd HCl và có tác dụng quỳ tím độ ẩm hóaxanh.Anilin(C 6 H 5 NH 2 ): KHÔNG làm đổi màu quỳtím.Lực bazo giảm dần dần theo chiều:C 2 H 5 NH 2 > CH 3 NH 2 > NH 3 > C 6 H 5 NH 2+Phản ứng màu biure :Protein + Cu(OH) 2 → màu sắc tím(VD: anbumin, lòng trắng trứng)
CHƢƠNG 4. POLIME:
a, một vài polime điều chế bởi phƣơng pháp trùng hợp : plietilen(PE), Poli(vinyl Clorua)(PVC), Polipropilen(PP),Poli
Stiren(PS), Poli(Vinyl Xianua), Caosubuna, Caosubuna – S, Caosubuna – N, tơ olonb, một trong những Polime điều chế bằng phƣơng pháp trùng ngƣng : Tơ nilon – 6, Tơ nilon – 7, Tơ nilon – 6,6; Tơ lapsan.c, một vài Polime sử dụng làm chất dẻo : plietilen(PE), Poli(vinyl Clorua)(PVC), Polipropilen(PP), Poli
Stiren(PS), chất liệu thủy tinh hữucơ(Plexiglas).d, một số cao su : Caosubuna, Caosubuna – S, Caosubuna – N, poliisopren(caosu isopren, cao su thiên nhiên).e, một số trong những tơ : Tơ olon, Tơ nilon – 6, Tơ nilon – 7, Tơ nilon – 6,6; Tơ lapsan.f, một số Polime thiên nhiên : cao su đặc thiên nhiên, Tơ tằm, tinh bột, xenlulozo, bông.g, một số trong những Polime nhân tạo(bán tổng hợp) : Tơ visco, Tơ axetat(xenlulozo triaxetat)→có nguồi gốc từ xenlulozo
II. LIPIT
Thạch cao: - Thạch cao khan : CaSO 4.Thạch cao sống : Ca
SO 4 .2H 2 O.Thạch cao nung : Ca
SO 4 .1H 2 O hoặc Ca
SO 4 .0,5H 2 O.→làm phấn, đúc tƣợng, bó bột khi gãy xƣơng.CHƢƠNG 7. SẮT, CROM VÀ HỢP CHẤT.1 , VỊ TRÍ, CẤU HÌNH e:
Fe: ở trong ô 26, chu kỳ luân hồi 4, team VIIIB.
Cấu hình e của Fe:
Cấu hình e của Fe2+ :
Cấu hình e của Fe3+ :
Cấu hình e Cr:
VIB.
Cấu hình e của Cr2+
Cấu hình e của Cr3+
Fe
O, sắt 2 O 3 , sắt 3 O 4 : oxit bazo.
Fe(OH) 2 , Fe(OH) 3 : Hidroxit bazo.
Cr
O 3 : Oxit axit (Cr có số oxh = +6).
Một số chất lƣỡng tính : 23
3
Cr O , Al 2 O 3 , Cr(OH) 3 ,Al(OH) 3 , Na
HCO 3 , Ca(HCO 3 ) 2.
O 4 : kali Cromat(Cr = +6)K 2 Cr 2 O 7 : kali đi
Cromat(Cr = +6)Nhỏ dd H 2 SO 4 loãng vào dd K 2 Cr
O 4 (Na 2 Cr
O 4 ): màu vàngchuyển thành màu domain authority cam.Nhỏ dd Na
OH(KOH) vào dd K 2 Cr 2 O 7 : màu da camchuyển thành màu vàng.3. MỘT SỐ QUẶNG tốt GẶP:Boxit : Al2O3 + Pirit :Fe
S2 (pirit sắt) + Xiderit : Fe
COXementit: Fe3C + Hematit đỏ: Fe2O3 + Hematit nâu: Fe2O3Đolomit: Ca
CO3 + Manhetit: Fe3O4 + Cromit: Fe
O 2 O 3* MỘT SỐ PHẢN ỨNG HÓA HỌC CẦN NHỚ:+ CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O.
Axit axetic ancol etylic etyl axetat
+ HCOOH + CH 3 OH HCOOCH 3 + H 2 OAxxit fomic ancol metylic metyl fomat
+ CH 3 COOH + CH 3 OH CH 3 COOCH 3 + H 2 O.Axit axetic ancol metylic metyl axetat
+ HCOOH + C 2 H 5 OH HCOOC 2 H 5 + H 2 OAxit fomic ancol etylic etyl fomat
HCOOC 2 H 5 + NaOH → t
0 HCOONa + C 2 H 5 OHEtyl fomat natri fomat
CH 3 COOCH 3 + NaOH → t
0 CH 3 COONa + CH 3 OHmetyl axetat natri axetat
CH 3 COOC 2 H 5 + NaOH → t
0 CH 3 COONa + C 2 H 5 OHEtyl axetat natri axetat
(RCOO) 3 C 3 H 5 + 3H 2 O → 3RCOOH + C 3 H 5 (OH) 3Chất béo axit mập glixerol(RCOO) 3 C 3 H 5 + 3NaOH → 3RCOONa + C 3 H 5 (OH) 3Chất bự Xà chống glixerol+ PƢ TRÁNG GƢƠNG( tráng bạc)C 6 H 12 O 6 Ag
NO 3 / NH 3 2Ag↓
Glu, Fruc
+ (C 6 H 10 O 5 )n + nH 2 O H n
C 6 H 12 O 6
(Tinh bột, xenlulozo) glucozo
+ C 6 H 12 O 6 enzim 2C 2 H 5 OH + 2CO 2CH 3 NH 2 + HCl → CH 3 NH 3 Cl.
CH 3 NH 2 + O 2 → t
0 2CO 2 + 2,5H 2 O +
21 N2
H 2 NCH 2 COOH + HCl → Cl
H 3 NCH 2 COOH
H 2 NCH 2 COOH + Na
OH → H 2 NCH 2 COONa + H 2 O.
Zn + 2HCl → Zn
Cl 2 + H 2
Zn + H 2 SO 4 → Zn
SO 4 + H 2
Fe + 2HCl → Fe
Cl 2 + H 2
Fe + H 2 SO 4 (l) → Fe
SO 4 + H 2
Fe + Cu
SO 4 → Fe
SO 4 + H 2
Fe + 4HNO 3 → Fe(NO 3 ) 3 + NO + 2H 2 O
Al + 4HNO 3 → Al(NO 3 ) 3 + NO + 2H 2 O
Al + 3HCl → Al
Cl 3 + 1,5H 2
Al + Na
OH + H 2 O → Na
Al
O 2 + 1,5H 2
2Al + fe 2 O 3 → t
0 Al 2 O 3 + 2Fe
Mg + 2HCl → MgCl 2 + H 2.Mg + H 2 SO 4 → Mg
SO 4 + H 2CO 2 + Ca(OH) 2 → Ca
CO 3 + H 2 ONa
OH + HCl → Na
Cl + H 2 OFe
Cl 3 + 3Na
OH → Fe(OH) 3 ↓ + 3Na
Cl
Nâu đỏ
SO 2 + 2Na
OH → mãng cầu 2 SO 3 + H 2 OCO 2 + 2Na
OH → na 2 co 3 + H 2 O2Na
HCO 3 → t
0 na 2 co 3 + teo 2 H 2 O
Ca(HCO 3 ) 2 + na 2 teo 3 → CaCO 3 ↓ + 2Na
HCO 3(Màu trắng)*** dung dịch lá: Nicotin
Mƣa axit: NO 2 với SO 2.Hiệu ứng đơn vị kính: teo 2 , CH 4Xử lý tà khí H 2 S: sử dụng dd Pb(NO 3 ) 2 hoặc
Pb(CH 3 COO) 2.Thu gom thủy ngân(Hg): dùng bột lƣu huỳnh(S).Xử lý xung khí Cl 2 : dd Ca(OH) 2Năng lƣợng sạch: nƣớc, gió, phương diện trời.Pb
S↓: màu sắc đen
Cd
S↓: màu sắc vàng**Thạch cao:









