Bài toán trộn lẫn các chất với nhau là 1 trong những dạng bài xích tập hay chạm mặt trong lịch trình hóa học tập phổ thông cũng giống như trong những đề thi bình chọn và đề thi tuyển sinh đại học, cao đẳng. Ta rất có thể giải bài xích tập dạng này theo vô số cách khác nhau, tuy nhiên việc giải loại dạng bài xích tập này hoàn toàn có thể giải theo phương thức sơ đồ con đường chéo
Nguyên tắc: xáo trộn hai dung dịch:
Dung dịch 1: có trọng lượng m1, thể tích V1, mật độ C1 (nồng độ phần trăm hoặc mật độ mol), khối lượng riêng d1.
Bạn đang xem: Hóa học quy tắc chéo
Dung dịch 2: có khối lượng m2, thể tích V2, mật độ C2 (C2 > C1 ), trọng lượng riêng d2.
Dung dịch thu được: có cân nặng m = m1 + m2, thể tích V = V1 + V2, độ đậm đặc C (C1 2) và cân nặng riêng d.
Sơ thiết bị đường chéo cánh và công thức tương ứng với từng trường hòa hợp là:

Khi áp dụng sơ đồ gia dụng đường chéo cần chú ý:
- chất rắn coi như dung dịch có C = 100%
- Dung môi coi như dung dịch bao gồm C = 0%
- khối lượng riêng của H2O là d = 1g/ml.
Sau đó là một số lấy ví dụ sử dụng cách thức sơ đồ vật đường chéo cánh trong thống kê giám sát các bài tập.
Ví dụ 1: Để thu được dung dịch HCl 25% nên lấy m1 gam dung dịch HCl 45% trộn với m2 gam hỗn hợp HCl 15%. Tỉ lệ thành phần m1/m2 là
A. 1:2. B. 1:3. C. 2:1. D. 3:1.
Hướng dẫn giải
Áp dụng cách làm (1):

Ví dụ 2: Để pha được 500 ml dung dịch nước muối bột sinh lý (C = 0,9%) đề nghị lấy V ml dung dịch Na
Cl 3% pha với nước cất. Giá trị của V là
A. 150 ml. B. 214,3 ml. C. 285,7 ml. D. 350 ml.
Hướng dẫn giải
Ta gồm sơ đồ:

V1 =
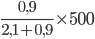
Ví dụ 3: phối hợp 200 gam SO3 vào m2 gam hỗn hợp H2SO4 49% ta được hỗn hợp H2SO4 78,4%. Quý hiếm của m2 là
A. 133,3 gam. B. 146,9 gam. C. 272,2 gam. D. 300 gam.
Hướng dẫn giải
Phương trình phản bội ứng:
SO3 + H2O H2SO4
100 gam SO3

Nồng độ hỗn hợp H2SO4 khớp ứng 122,5%.
Gọi m1, mét vuông lần lượt là khối lượng của SO3 cùng dung dịch H2SO4 49% bắt buộc lấy. Theo (1) ta có:

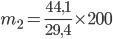
Ví dụ 4: Nguyên tử khối vừa phải của brom là 79,319. Brom tất cả hai đồng vị bền:


A. 84,05. B. 81,02. C. 18,98. D. 15,95.
Hướng dẫn giải
Ta gồm sơ đồ mặt đường chéo:



Ví dụ 5: Một láo lếu hợp gồm O2, O3 ở đk tiêu chuẩn có tỉ khối khá với hiđro là 18. Thành phần % về thể tích của O3 trong tất cả hổn hợp là
A. 15%. B. 25%. C. 35%. D. 45%.
Hướng dẫn giải
Áp dụng sơ đồ con đường chéo:



Ví dụ 6: yêu cầu trộn nhị thể tích metan với nhân thể tích đồng đẳng X của metan để thu được tất cả hổn hợp khí có tỉ khối khá so cùng với hiđro bởi 15. X là
A. C3H8. B. C4H10. C. C5H12. D. C6H14.
Hướng dẫn giải
Áp dụng sơ đồ con đường chéo:

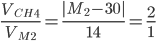
mét vuông = 58 Þ 14n + 2 = 58 Þ n = 4.
Vậy: X là C4H10. (Đáp án B)
Ví dụ 7: Thêm 250 ml hỗn hợp Na
OH 2M vào 200 ml hỗn hợp H3PO4 1,5M. Muối chế tác thành và cân nặng tương ứng là
A. 14,2 gam Na2HPO4 ; 32,8 gam Na3PO4.
B. 28,4 gam Na2HPO4 ; 16,4 gam Na3PO4.
C. 12 gam Na
H2PO4 ; 28,4 gam Na2HPO4.
D. 24 gam Na
H2PO4 ; 14,2 gam Na2HPO4.
Hướng dẫn giải
Có:

tạo ra hỗn hợp 2 muối: Na
H2PO4, Na2HPO4.
Sơ đồ đường chéo:



Mà:



Ví dụ 8: phối hợp 3,164 gam các thành phần hỗn hợp 2 muối Ca
CO3 cùng Ba
CO3 bằng dung dịch HCl dư, thu được 448 ml khí CO2 (đktc). Yếu tố % số mol của Ba
CO3 trong hỗn hợp là
A. 50%. B. 55%. C. 60%. D. 65%.
Hướng dẫn giải
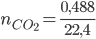

Áp dụng sơ đồ con đường chéo:


Ví dụ 9: phải lấy từng nào gam tinh thể Cu
SO4.5H2O và bao nhiêu gam dung dịch Cu
SO4 8% nhằm pha thành 280 gam hỗn hợp Cu
SO4 16%?
A. 180 gam với 100 gam. B. 330 gam và 250 gam.
C. 60 gam cùng 220 gam. D. 40 gam với 240 gam.
Hướng dẫn giải

SO4.5H2O như thể dung dịch Cu
SO4 có:
C% =

Gọi m1 là khối lượng của Cu
SO4.5H2O và mét vuông là khối lượng của dung dịch Cu
SO4 8%.
Theo sơ đồ con đường chéo:


Xem thêm: Giải Toán Nâng Cao Lớp 2 - 80 Bài Toán Ôn Luyện Học Sinh Giỏi Lớp 2
Mặt khác m1 + mét vuông = 280 gam.
Vậy khối lượng Cu
SO4.5H2O là:
m1 =
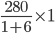
và trọng lượng dung dịch Cu
SO4 8% là:
m2 = 280 - 40 = 240 gam. (Đáp án D)
Ví dụ 10: Cần từng nào lít axit H2SO4 (D = 1,84) và bao nhiêu lít nước chứa để trộn thành 9 lít dung dịch H2SO4 bao gồm D = 1,28 gam/ml?
A. 2 lít với 7 lít. B. 3 lít với 6 lít.
C. 4 lít cùng 5 lít. D. 6 lít và 3 lít.
Hướng dẫn giải
Ta có sơ đồ mặt đường chéo:


Cần bắt buộc lấy

MỘT SỐ BÀI TẬP VẬN DỤNG GIẢI THEO PHƯƠNG PHÁP SƠ ĐỒ ĐƯỜNG CHÉO
1. Hòa tan trọn vẹn m gam Na2O nguyên chất vào 40 gam dung dịch Na
OH 12% thu được hỗn hợp Na
OH 51%. Quý giá của m (gam) là:
A. 11,3. B. 20,0. C. 31,8. D. 40,0.
2. Thể tích nước nguyên chất buộc phải thêm vào 1 lít hỗn hợp H2SO4 98% (d = 1,84 g/ml) để được dung dịch mới tất cả nồng độ 10% là
A. 14,192 ml. B. 15,192 ml. C. 16,192 ml. D. 17,192 ml.
3. Nguyên tử khối mức độ vừa phải của đồng 63,54. Đồng gồm hai đồng vị bền:

A. 73,0%. B. 34,2%. C.32,3%. D. 27,0%.
4. Buộc phải lấy V1 lít CO2 cùng V2 lít CO để có được 24 lít các thành phần hỗn hợp CO2 cùng CO có tỉ khối hơi so với metan bởi 2. Giá trị của V1 (lít) là
A. 2. B. 4. C. 6. D. 8.
5. Thêm 150 ml hỗn hợp KOH 2M vào 120 ml hỗn hợp H3PO4 1M. Trọng lượng các muối hạt thu được trong hỗn hợp là
A. 10,44 gam KH2PO4 ; 8,5 gam K3PO4.
B. 10,44 gam K2HPO4 ; 12,72 gam K3PO4.
C. 10,44 gam K2HPO4 ; 13,5 gam KH2PO4.
D. 13,5 gam KH2PO4 ; 14,2 gam K3PO4.
6. Hài hòa 2,84 gam các thành phần hỗn hợp 2 muối Ca
CO3 và Mg
CO3 bởi dung dịch HCl (dư) chiếm được 0,672 lít khí ở đk tiêu chuẩn. Yếu tố % số mol của Mg
CO3 trong hỗn hợp là
A. 33,33%. B. 45,55%. C. 54,45%. D. 66,67%.
7. Lượng SO3 yêu cầu thêm vào hỗn hợp H2SO4 10% sẽ được 100 gam hỗn hợp H2SO4 20% là
A. 2,5 gam. B. 8,88 gam. C. 6,66 gam. D. 24,5 gam.
8. Hỗn hợp rượu etylic 13,8o có d (g/ml) =?. Biết

A. 0,805. B. 0,8 55. C. 0,972. D. 0,915.
9. Hòa hợp m gam Al bởi dung dịch HNO3 loãng thu được hỗn hợp khí NO với N2O gồm tỉ khối đối với H2 bằng 16,75. Tỉ lệ thành phần thể tích khí trong hỗn hợp là
A. 2 : 3. B. 1 : 2. C. 1 : 3. D. 3 : 1.
10. Từ một tấn quặng hematit A điều chế được 420 kg Fe. Từ là một tấn quặng manhetit B pha trộn được 504 kilogam Fe. Hỏi đề xuất trộn hai quặng trên với tỉ lệ cân nặng (m
A : m
B) là từng nào để được 1 tấn quặng tất cả hổn hợp mà từ là một tấn quặng các thành phần hỗn hợp này pha trộn được 480 kg Fe.
Chủ đề quy tắc mặt đường chéo: phép tắc đường chéo là một cách thức hiệu trái được vận dụng trong giải quyết và xử lý các việc hỗn hợp đựng được nhiều thành phần. Phương pháp này góp ta khẳng định tỉ lệ những chất dựa trên các đại lượng như phân tử khối trung bình, số nguyên tử trung bình. Phép tắc đường chéo cánh được đánh giá cao vì tính chính xác và ứng dụng rộng thoải mái trong các nghành khoa học cùng công nghệ.
Quy tắc con đường chéo, nói một cách khác là quy tắc tỉ lệ pha loãng là 1 trong những quy tắc được vận dụng trong nghành nghề hóa học. Nó được sử dụng để giám sát tỉ lệ trộn loãng của các chất chất hóa học khi ta xáo trộn chúng cùng với nhau.Công thức của luật lệ đường chéo có thể được màn trình diễn bằng sơ vật như sau:X (chất 1)//V\\Y (chất 2)Trong đó, X cùng Y là những chất cần pha trộn với nhau nhằm thu được V lít dung dịch. Độ cồn của hỗn hợp là C. C1 và C2 là độ động của chất X với Y, cùng C1 > C > C2.Để giám sát tỉ lệ pha loãng, ta áp dụng quy tắc đường chéo như sau:1. Vẽ sơ vật dụng quy tắc đường chéo cánh như trên.2. Đặt những giá trị C1, C và C2 vào những vạch tương ứng trên sơ đồ.3. Từ các giá trị vẫn cho, ta có thể suy ra tỉ lệ pha loãng của X và Y trong hỗn hợp theo công thức:Tỉ lệ trộn loãng X = (C - C2) / (C1 - C2)Tỉ lệ pha loãng Y = (C1 - C) / (C1 - C2)4. Áp dụng các giá trị vẫn tính được để khẳng định tỉ lệ trộn loãng của X và Y.Quy tắc đường chéo cánh được sử dụng trong số bài toán hóa học liên quan đến trộn trộn các chất hoặc dung dịch có độ cồn không giống nhau để dành được một độ hễ nhất định.
Quy tắc đường chéo, còn được gọi là quy tắc nứt đường chéo (cross-coupling) là một cách thức hữu ích trong hóa học hữu cơ. Phương thức này được sử dụng để phối kết hợp hai hợp hóa học hữu cơ để tạo nên một thích hợp chất new có cấu tạo phức tạp hơn.Để vận dụng quy tắc này, bạn phải sử dụng các chất phản nghịch ứng có chứa các nhóm chức nền tảng, ví dụ điển hình như các nhóm nitơ, oxi, hoặc cacbon. Các nhóm này có thể tạo link với những hợp chất khác thông qua phản ứng cặp năng lượng điện tử trường đoản cú do.Cách áp dụng quy tắc đường chéo có thể khá phức hợp và trải qua nhiều bước phản ứng. Mặc dù nhiên, ý tưởng chung là kết hợp các phù hợp chất áp dụng một chất xúc tác, thường là 1 trong những kim loại chuyển tiếp như palladium, platinum, hoặc nickel.Áp dụng quy tắc đường chéo có thể tạo thành các sản phẩm tinh vi hơn và tạo đk cho việc tổng hợp những hợp chất hữu ích. Phương thức này đã làm được sử dụng rộng thoải mái trong phân tích và sản xuất những hợp hóa học hữu cơ có chân thành và ý nghĩa quan trọng vào các lĩnh vực như dược phẩm, vật tư và technology môi trường.Ngoài ra, quy tắc đường chéo cánh cũng rất có thể được áp dụng trong nghành nghề dịch vụ nghiên cứu vớt vật liệu, phân tích cơ quan liên kết và năm học, như quy tắc liên kết hóa học.
Quy tắc đường chéo cánh là một cách thức quan trọng trong đo lường hóa học vì nó cho phép chúng ta dự đoán số liệu về một hóa học khi ta biết các thông số kỹ thuật của phần đa chất không giống liên quan.Quy tắc này dựa vào việc sản xuất một mạng lưới những quy tắc tương quan đến mối tương tác giữa các chất, ví dụ như khối lượng, phương pháp hóa học, độ tan, độ hoạt động, và ánh nắng mặt trời chảy. Khi có thông tin về một hóa học trong mạng lưới này, chúng ta có thể xác định thông tin về chất khác mà không biết.Cách thức hoạt động vui chơi của quy tắc đường chéo cánh là dựa trên việc xây dựng những quy tắc contact giữa những chất dựa trên kinh nghiệm thực tiễn và các cơ sở lý thuyết. Ví dụ, nếu chúng ta biết về khối lượng một hóa học như axit sunfuric, chúng ta cũng có thể áp dụng nguyên tắc đường chéo để xác định trọng lượng của một chất khác có tương quan như muối sunfat. Quy tắc này đến phép chúng ta dự đoán thông tin về các chất new mà chưa được nghiên cứu trực tiếp.Tuy nhiên, phép tắc đường chéo cánh cũng tất cả nhược điểm là nó chỉ có đặc thù xấp xỉ và dự đoán. Việc áp dụng quy tắc này yêu cầu bọn họ có kiến thức và kỹ năng và tởm nghiệm không hề thiếu về những quy tắc tương quan và rất cần được kiểm chứng bằng những thí nghiệm thực tế.Tóm lại, luật lệ đường chéo là một phương pháp quan trọng trong thống kê giám sát hóa học bởi vì nó mang lại phép bọn họ dự đoán thông tin về các chất bắt đầu dựa trên thông tin đã biết. Tuy nhiên, việc áp dụng quy tắc này cần cảnh giác và kiểm chứng bằng thực nghiệm.

Quy tắc đường chéo cánh - bồi dưỡng HSG hóa học
Quy tắc con đường chéo: Hãy mày mò cách áp dụng quy tắc đường chéo trong câu hỏi giải các bài toán hình học tập phức tạp. đoạn phim sẽ reviews những ví dụ rõ ràng giúp bạn nắm rõ và vận dụng quy tắc này một cách chính xác và thành thạo.
Cách xác định tỉ lệ các chất trong bài toán thực hiện quy tắc mặt đường chéo bao hàm các bước sau đây:Bước 1: Đề bài xích thường cho thấy các hóa học tham gia trong phản nghịch ứng và con số của chúng. Ghi rõ các chất và số lượng vào sơ trang bị hoá học.Bước 2: khẳng định công thức của bộ phận hoặc chất được yêu ước tính tỉ lệ. Đây là hóa học mà bạn ước ao muốn xác minh tỉ lệ, ví dụ: khối lượng, số mol, thể tích, v.v.Bước 3: xác minh thông số của hóa học đã biết. Đây là các thông số kỹ thuật đã được đề bài xích cung cấp, ví dụ: khối lượng, số mol, thể tích, v.v.Bước 4: thực hiện quy tắc đường chéo để tính tỉ lệ. Đưa ra sơ đồ vật mô phỏng quy tắc đường chéo cánh với các thông số kỹ thuật đã xác định ở cách 3. Trong sơ đồ, viết các con số hoặc tỉ lệ của các chất. Xác minh mối quan hệ giữa những chất trải qua công thức hóa học.Bước 5: giải quyết phương trình đường chéo để search tỉ lệ của chất được yêu cầu. Điền vào luật lệ đường chéo cánh các thông số kỹ thuật đã biết và để trống thông số bạn muốn tìm. Sau đó, giải phương trình nhằm tìm quý giá của thông số đó.Bước 6: Đọc tác dụng và report tỉ lệ những chất các bạn đã tính được.Chú ý, phép tắc đường chéo cánh chỉ áp dụng cho các bài toán có cùng thành phần bội nghịch ứng. Nếu những chất tham gia khác nhau, cần sử dụng các công thức và phương thức khác nhau nhằm tính tỉ lệ.
Trong ví dụ như minh họa, luật lệ đường chéo được vận dụng để tính tỉ lệ các chất. Phép tắc này có thể được sử dụng cho những đại lượng, phân tử khối trung bình, số nguyên tử mức độ vừa phải và những đại lượng tương tự.Để phân tích và lý giải cách tính tỉ lệ những chất bằng quy tắc mặt đường chéo, chúng ta sẽ để ý ví dụ sau:Giả sử bọn họ có 3 chất A, B với C và họ muốn biết xác suất giữa chúng. Ta hiểu được chất A và B kết hợp với nhau để tạo ra thành hóa học AB, và chất B cùng C kết phù hợp với nhau để chế tác thành chất BC.Ta sẽ thực hiện các thông số kỹ thuật sau:- chất A có khối lượng 2g- chất B có khối lượng 3g- chất C có khối lượng 4g
Đầu tiên, ta xác định tỉ lệ giữa cân nặng chất AB và hóa học BC trong ví dụ này.Theo quy tắc con đường chéo, ta đã đặt các khối lượng chất A, B với C vào trong 1 hình chữ nhật như sau:A B--------B CTa sẽ phân chia đôi hình chữ nhật thành nhì phần đều nhau bằng một đường chéo như sau:A B-----+--B CSau đó, ta kẻ những đường chéo cánh khác để sản xuất thành một hình tam giác:A B-----+--B \ CBây giờ ta sẽ chu đáo tỉ lệ giữa các đại lượng trong những hình tam giác nhỏ tạo ra vì chưng đường chéo. Vào trường thích hợp này, ta vẫn so sánh khối lượng chất AB và BC.Đối với hai đại lượng trong tam giác bên trái, có nghĩa là A cùng B, ta nhận thấy rằng trọng lượng của bọn chúng là 2g cùng 3g. Bởi vậy, tỉ trọng giữa chúng là 2:3.Đối với hai đại lượng vào tam giác mặt phải, tức là B cùng C, ta phân biệt rằng trọng lượng của chúng là 3g với 4g. Vì chưng vậy, tỉ trọng giữa bọn chúng là 3:4.Cuối cùng, ta đối chiếu tỉ lệ giữa trọng lượng chất AB và BC. Xác suất này được xác định bằng cách so sánh tỉ lệ giữa những đại lượng vào tam giác bên trái và tam giác bên phải. Trong trường hợp này, ta gồm tỉ lệ 2:3 cho hóa học AB với 3:4 cho hóa học BC.Vậy tỉ trọng giữa chất AB cùng BC là 2:3 x 3:4 = 6:12 = 1:2.Như vậy, trong lấy ví dụ như này, chúng ta có tỉ lệ thành phần giữa hóa học AB với BC là 1:2.

Phương pháp đường chéo trong chất khí với đồng vị - Thầy Nguyễn Trung Thuyên
Phương pháp con đường chéo: nếu như khách hàng đang tìm kiếm phương pháp giải quyết các bài toán cạnh tranh trong hình học, hãy xem video clip này. Cách thức đường chéo được trình bày một cách chi tiết và dễ hiểu, giúp đỡ bạn nắm vững chuyên môn này để giải quyết các vấn đề trong thời hạn ngắn.
Quy tắc đường chéo có thể được áp dụng vào việc thống kê giám sát các đại lượng nào khác ko kể tỉ lệ các chất?
Quy tắc đường chéo cánh không chỉ vận dụng để đo lường tỉ lệ những chất nhưng còn có thể được sử dụng trong nhiều bài toán khác. Dưới đấy là một số ví dụ:1. Xác định công thức hóa học: phép tắc đường chéo có thể giúp xác định công thức hóa học của một vừa lòng chất lúc biết tỉ lệ các nguyên tố vào đó. Ví dụ, nếu biết tỉ lệ phần trăm các nguyên tố trong một phù hợp chất, ta rất có thể sử dụng luật lệ đường chéo cánh để khẳng định công thức chất hóa học tương ứng.2. Tính toán hàm lượng hoá học: Khi tất cả hỗn phù hợp gồm các chất gồm hàm lượng khác nhau, nguyên tắc đường chéo có thể giúp xác định hàm lượng của một chất nếu biết tỉ lệ với những chất không giống trong lếu hợp. Điều này rất có thể áp dụng trong so với hoá học tập và technology môi trường.3. đo lường và tính toán hợp lẻ, hoặc hoàn một phản nghịch ứng: phép tắc đường chéo cũng hoàn toàn có thể áp dụng để đo lường và thống kê hợp lẻ trong những phản ứng hóa học. Ví dụ, trường hợp biết tỉ lệ phản nghịch ứng thân hai hóa học tham gia, ta hoàn toàn có thể sử dụng phép tắc đường chéo để khẳng định tỉ lệ thành phầm hoặc chất dựa vào vào tỉ lệ phản ứng ban đầu.Dễ thấy rằng, phép tắc đường chéo cánh có thể được áp dụng trong nhiều nghành nghề khác nhau, không những giới hạn vào việc đo lường và thống kê tỉ lệ các chất. Vấn đề hiểu và sử dụng quy tắc đường chéo một bí quyết linh hoạt đã giúp chúng ta giải quyết nhiều bài bác toán khác biệt trong nghành nghề hóa học tập và những ngành công nghệ khác.
Lợi ích và vận dụng của phép tắc đường chéo trong việc xác minh công thức và đo lường các đại lượng hóa học?
Quy tắc con đường chéo, còn gọi là quy tắc lũy tiến, là một cách thức được thực hiện trong việc khẳng định công thức và đo lường và thống kê các đại lượng chất hóa học như phân tử khối trung bình, tỉ lệ tỷ lệ của các nguyên tố trong vừa lòng chất, số nguyên tử vừa phải và những đại lượng khác.Lợi ích thiết yếu của luật lệ đường chéo là góp ta xác định công thức đúng đắn có thể của một hóa chất dựa trên các thông tin như tỉ lệ tỷ lệ của các nguyên tố trong chất đó. Điều này rất có ích trong việc xác định thành phần chất đó và nắm rõ hơn về tính chất và đặc điểm của nó.Ứng dụng của phép tắc đường chéo cánh cũng rất rộng rãi trong lĩnh vực hóa học. Ví dụ, nó rất có thể được áp dụng để đo lường và thống kê phân tử khối mức độ vừa phải của một tất cả hổn hợp chất. Bằng cách xác định tỉ lệ phần trăm của những nguyên tố trong hỗn hợp, ta rất có thể tính toán phân tử khối vừa đủ theo công thức:M = x₁M₁ + x₂M₂ + ...,Trong kia M là phân tử khối trung bình, x là tỉ lệ phần trăm của từng nguyên tố, với M là trọng lượng nguyên tử của nhân tố tương ứng.Ngoài ra, luật lệ đường chéo cánh cũng rất có thể được áp dụng để thống kê giám sát số nguyên tử trung bình của các nguyên tố vào một vừa lòng chất. Bằng phương pháp biết tỉ lệ xác suất của từng nguyên tố cùng số nguyên tử trung bình của các nguyên tố kia trong hòa hợp chất, ta hoàn toàn có thể xác định số nguyên tử vừa phải theo công thức:N = (x₁N₁ + x₂N₂ + ...) / 100,Trong đó N là số nguyên tử trung bình, x là tỉ lệ xác suất của từng nguyên tố, cùng N là số nguyên tử của nguyên tử tương ứng.Như vậy, quy tắc đường chéo giúp ta áp dụng các công thức và thống kê giám sát một cách đúng mực và công dụng trong việc khẳng định công thức và đo lường và thống kê các đại lượng hóa học. Với công dụng và ứng dụng đa dạng như vậy, phép tắc đường chéo là một qui định hữu ích luôn luôn phải có trong nghiên cứu và phân tích và ứng dụng của hóa học.

Pha X cùng pha Y rất có thể được hòa trộn với nhau theo luật lệ đường chéo để sinh sản thành trộn V tất cả tỉ lệ tốt nhất định, vậy công thức vận dụng và cách đo lường trong trường vừa lòng này là gì?
Trong trường vừa lòng này, nguyên tắc đường chéo được sử dụng để đo lường và tính toán tỉ lệ của những chất X cùng Y trong pha V. Công thức áp dụng là:(V1/V) = (C - C2)/(C1 - C2)Trong đó:- V1 là thể tích của trộn X (được trộn với Y) - V là tổng thể và toàn diện tích của pha phối kết hợp V- C1 là độ cồn của pha X- C2 là độ rượu cồn của trộn Y- C là độ động của pha phối hợp VDựa vào công thức trên, ta có thể tính toán tỷ lệ V1/V và từ đó tính được thể tích của các pha X và Y vào pha phối kết hợp V.Ví dụ:Cho V = 100 lít, C1 = 40%, C2 = 20%(V1/V) = (C - C2)/(C1 - C2)(V1/100) = (C - 20)/(40 - 20)(V1/100) = (C - 20)/20Giả sử ta mong muốn pha V gồm độ cồn C = 30%, ta rất có thể thay C = 30% vào cách làm trên với giải phương trình nhằm tìm quý giá của V1.
Hóa học Lớp 12 - Giải bài xích tập hóa học bằng đường chéo cánh và trung bình
Bài tập hóa học: khám phá và làm cho quen với các bài tập hóa học thú vui và thu hút trong đoạn clip này. Bạn sẽ được lí giải từ cơ bạn dạng đến nâng cao, khiến cho bạn rèn luyện kỹ năng trong việc giải các bài tập hóa học một cách hối hả và thiết yếu xác.
Áp dụng quy tắc mặt đường chéo, làm cố gắng nào để tính được độ hễ C khi hòa trộn hai dung dịch có độ rượu cồn khác nhau?
Để tính độ cồn C khi hòa trộn hai dung dịch tất cả độ đụng khác nhau, ta hoàn toàn có thể áp dụng phép tắc đường chéo cánh như sau:Bước 1: xác định độ đụng của hỗn hợp 1 (C1) với dung dịch 2 (C2).Bước 2: Vẽ một đường chéo cánh (đường vội vàng khúc) và chia nó thành 3 phần. Ở phần ngang đầu tiên, chớp nhoáng viết C1 và C2. Trong phần ngang sản phẩm hai, viết C là độ cồn nên tìm.Bước 3: Đặt C1, C2 và C trên những cạnh của đường chéo. Đặt V1 cùng V2 là thể tích của dung dịch 1 với dung dịch 2 sẽ hòa trộn, tương ứng.Bước 4: Áp dụng nguyên tắc đường chéo như sau: nhân C1 với V1, nhân C2 với V2, và cộng hai hiệu quả lại nhằm tính tổng. Đặt tác dụng này bằng GT.Bước 5: tự phần giao của đường chéo cánh và phần ngang sản phẩm ba, ta gồm công thức sau:C * (V1 + V2) = GTBước 6: Giải phương trình trên để tính độ rượu cồn C.Khi sẽ biết phương pháp trên và quý giá của C1, C2, V1, V2 với GT, ta có thể thay vào và giải phương trình nhằm tìm ra cực hiếm của độ hễ C.Lưu ý: Áp dụng phép tắc đường chéo chỉ mang tính chất xê dịch và có thể gặp sai số duy nhất định.

Có, nguyên tắc đường chéo có thể vận dụng trong cả các bài toán khác không tính hóa học. Tuy nhiên quy tắc này hay được thực hiện để giải những bài toán tương quan đến trộn chất, tính chất hóa học trong tất cả hổn hợp và xác minh nồng độ, nhưng chế độ và định hướng của phép tắc đường chéo rất linh hoạt và rất có thể áp dụng vào nhiều nghành nghề dịch vụ khác nhau.Ví dụ, luật lệ đường chéo cánh có thể được áp dụng trong số bài toán về bố cục tổng quan và kiến thiết nghệ thuật. Lúc tạo bố cục cho một cống phẩm nghệ thuật, bạn có thể sử dụng luật lệ đường chéo cánh để chế tạo ra sự hài hòa và hợp lý và cân đối giữa các yếu tố vào tác phẩm. Hiệ tượng này giúp xác định và tạo thành sự can hệ giữa những yếu tố vào tác phẩm, từ bỏ đó tạo ra một cảm xúc thẩm mỹ và coherence.Ngoài ra, luật lệ đường chéo cũng rất có thể được áp dụng trong các bài toán tương quan đến xây dựng, kiến trúc và xây đắp sản phẩm. Cùng với việc vận dụng quy tắc này, chúng ta có thể tạo ra các xây đắp và sản phẩm có tỉ trọng và bằng vận hài hòa, trường đoản cú đó mang đến sự thẩm mỹ và làm đẹp và tác dụng tối ưu.









