Doc.com KHÔNG quảng cáo, với tải file rất nhanh không đợi đợi.
Các công thức hóa học tập lớp 9 Đầy đủ nhất được Vn
Doc biên soạn tổng hợp bao hàm các phương pháp tính toán, giải bài xích tập Hóa 9 từ bỏ chương 1 cho chương 5 Hóa 9, giúp các em núm ghi nhớ bí quyết và vận dụng vào làm những bài tập tương quan hiệu quả. Mời các bạn tham khảo chi tiết sau đây.
Bạn đang xem: Công thức môn hóa lớp 9
Công thức chất hóa học lớp 9 theo từng chương
Chương 1. Những loại hợp hóa học vô cơ Chương 2. Kim loại Chương 4. HiđrocacbonChương 1. Các loại hợp chất vô cơ
Dạng việc CO2/SO2 chức năng với dung dịch kiềm
Oxit axit thường thực hiện là CO2 với SO2. Hỗn hợp kiềm thường xuyên được sử udngj:
Nhóm 1: Na
OH, KOH (kim nhiều loại hóa trị I)
Nhóm 2: Ca(OH)2, Ba(OH)2 (kim nhiều loại hóa trị II)
Phương pháp giải
1. Việc CO2, SO2 đưa vào dung dịch Na
OH, KOH
Khi đến CO2 (hoặc SO2) công dụng với dung dịch Na
OH đều xảy ra 3 tài năng tạo muối:
CO2 + 2Na
OH → Na2CO3 + H2O (1)
CO2 + Na
OH → Na
HCO3 (2)
Đặt T = n
Na
OH/n
CO2
Nếu T = 2: chỉ chế tạo ra muối Na2CO3
Nếu T ≤ 1: chỉ chế tác muối Na
HCO3
Nếu 1 3 với Na2CO3
2. Việc CO2, SO2 đưa vào dung dịch Ca(OH)2, Ba(OH)2
Do ta không biết thành phầm thu được là muối bột nào phải phải tính tỉ lệ thành phần T:
Ca(OH)2 + CO2 → Ca
CO3↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Đặt T = n
CO2 : n
Ca(OH)2
Nếu T ≤ 1: chỉ sinh sản muối Ca
CO3
Nếu T = 2: chỉ tạo thành muối Ca(HCO3)2
Nếu 1 3 cùng Ca(HCO3)2
3. Lấy ví dụ minh họa
Ví dụ. biết rằng 4,48 lít khí CO2 (ở đktc) công dụng vừa đủ vơi 400ml Na
OH chế tạo thành muối bột trung hòa.
a) Tính trọng lượng muối thu được
b) Tính độ đậm đặc mol của hỗn hợp Na
OH sẽ dùng
Hướng dẫn giải bỏ ra tiết
Sản phẩm tạo thành thành muối th-nc → là Na2CO3
Phương trình chất hóa học của làm phản ứng:
CO2 + 2Na
OH → Na2CO3 + H2O
0,2→ 0,4 → 0,2
Số mol CO2: n
CO2 = 0,2 mol
a) cân nặng Na2CO3 chế tạo ra thành: m
Na2CO3 = 0,2.106 = 21,2 gam
b) độ đậm đặc mol dung dịch Na
OH sẽ dùng: CMNa
OH = 0,4/0,4 = 1 M
Chương 2. Kim loại
1. Cách thức tăng bớt khối lượng
A + B2(SO4)n → A2(SO4)m + B
Trường đúng theo 1: m
A (tan) B (bám)
m B (bám) – m A (tan) = m kim loại tăng
Trường phù hợp 2: m
A (tan) > m
B (bám)
m A (tan) – m B (bám) = m sắt kẽm kim loại giảm
2. Bảo toàn khối lượng
∑m các chất tham gia = ∑ m hóa học tạo thành
m thanh kim loại + m dung dịch = m" thanh sắt kẽm kim loại + m" dung dịch
Phản ứng nhiệt nhôm:
n
H2 = n
Fe + (3/2).n
Al
n
H2 = n
Fe + (3/2).n
Al
Chương 3. Phi kim
Trong các phản ứng của C, CO, H2 thì số mol CO= n
CO2, n
C= n
CO2, n
H2= n
H2O.
m bình tăng = m hấp thụ
m dd tăng = m dung nạp - m kết tủa
m dd bớt = m kết tủa – m hấp thụ
Chương 4. Hiđrocacbon
1. Lập công thức phân tử của hợp chất hữu cơ
Bước 1: tìm phân tửu khối của hợp hóa học hữu cơ
Phân tử khối của vừa lòng chấy hữu cơ có thể được tính theo các cách sau:
Dựa vào trọng lượng mol hợp hóa học hữu cơ: M = 12x + y + 16z (g/mol)
Dựa vào công thức tương tác giữa khối lượng và số mol: M = m/n
Dựa vào tỉ khối (Áp dụng với các chất khí): d
A/B = MA/MB; d
A/kk = MA/Mkk =MA/29
Bước 2: Lập bí quyết phân tử của hợp hóa học hữu cơ
Dựa vào phần trăm trọng lượng của những nguyên tố: %m
C/12 = %m
H/1 = %m
O/16
Dựa vào công thức đơn giản nhất: Kí hiệu công thức phân tử (CTPT), công thức đơn giản nhất = CTĐGN
CTPT = (CTĐGN)n
2. Tìm công thức phân tử bởi phản ứng cháy của hợp hóa học hữu cơ
Bước 1: Lập công thức bao quát của hợp chất hữu cơ: Cx
Hy
Oz
Bước 2: đổi khác các đại lượng đầu bài bác cho thành số mol.
Bước 3: Viết phương trình bao quát của bội phản ứng cháy:

Bước 4: cấu hình thiết lập tỉ lệ số mol các nguyên tố trong công thức
Tìm trọng lượng mỗi nguyên tố

TH1: m
Cx
Hy
Oz = m
C + m
H => m
O = 0, vào côn thức phân tửu chỉ tất cả C cùng H (hidrocabon)
TH2: m
O > 0, trong phương pháp phân tử bao gồm cả C, H, O
Tìm số mol nguyên tử của từng nguyên tố, cấu hình thiết lập tỉ lệ số mol

Bước 5: Biện luận CTPT của hợp chất hữu cơ: M = (Cx
Hy
Oz)n => n, M
Chương 5. Dẫn xuất của hidrocacbon - Polime
Độ rượu
Khái niệm: Độ rượu được có mang là số mol etylic tất cả trong 100 ml các thành phần hỗn hợp rượu cùng với nước.
Công thức tính độ rượu:
Độ rượu =

Như ta biết: tỉ khối cảu ancol etylic (d1 = 0,8g/cm3), tỉ khối của nước (d2 = 1g/cm3)
Biến đổi (1) về độ rượu ta có:
Độ rượu =

Công thức tính cân nặng riêng
D = m/V (g/ml)
Bài tập vận dụng
Câu 1: đến 23 gam rượu etylic nguyên chất tác dụng với natri dư. Thể tích khí H2 bay ra (đktc) là bao nhiêu?
Đáp án khuyên bảo giải
n
C2H5OH = 23/46 = 0,5 mol
2C2H5OH + 2Na → 2C2H5ONa + H2↑
0,5 mol → 0,25 mol
=>VH2 = 0,25.22,4 = 5,6
Câu 2: Biết cân nặng riêng của C2H5OH là 0,8 gam/ml, lúc đó trọng lượng glucozo cần để pha chế 1 lit dd rượu etylic 40º với công suất 80% là bao nhiêu?
Đáp án hướng dẫn giải
Vrượu = Độ rượu.Vdd = 0,23.1000 = 230 ml
⇒ mrượu = Vrượu.D = 230.0,8 = 184 gam
C2H5OH + O2 → CH3COOH + H2O
46 → 60
184 → m = ?
⇒ m
CH3COOH = 184.60/46 = 240 gam
C6H12O6 → 2C2H5OH
180 → 92
m = ? ← 320
⇒ Vancol = Độ rượu.Vdd = 0,4.1000 = 400 ml
⇒ mancol = Vancol.D = 400.0,8 = 320 gam
⇒ mglucozo = 320.180.100/(92.80) = 782,6 gam
Câu 3: mang lại 11,2 lít khí etilen (đktc) công dụng với nước có axit sunfuric (H2SO4) làm xúc tác, nhận được 9,2 gam rượu etylic. Năng suất phản ứng là bao nhiêu?
Đáp án gợi ý giải
Số mol khí etilen là: n
C2H4 = 11,2/22,4 = 0,5mol
Phương trình hóa học
C2H4 + H2O

0,5 mol → 0,5 mol
=> khối lượng rượu etylic chiếm được theo lí thuyết là: m = 0,5.46 = 23 gam
Đề bài xích cho cân nặng rượu etylic thu được thực tế là 9,2 gam
Vì tính theo chất sản phẩm
=> công suất phản ứng H = mthực tế/mlí thuyết.100%=9,2/23.100% = 40%
Câu 4: Cần từng nào thể tích rượu nguyên chất bỏ vào 60 ml hỗn hợp rượu 40o thành rượu 60o?
Đáp án lý giải giải
Thể tích rượu nguyên chất trong dung dịch lúc đầu là
Độ rượu = Vrượu nguyên chất/Vdd.100
=> Vrượu nguyên chất = (Độ rượu.Vdd)/100 = 40.60/100 = 24ml
Thể tích dung dịch rượu nguyên chất sau thời điểm pha là: 24 + x (ml)
Thể tích hỗn hợp rượu thời điểm sau là: 60 + x (ml)
Thay vào cách làm tính độ rượu thời điểm sau, ta có:
60 = (24 + x)/(60 + x).100 =>x = 30ml
Vậy trường hợp ta thêm 30 ml rượu nguyên hóa học vào 60 ml rượu 40o thì sẽ thành rượu 60o
Câu 5. Khí CO2 sinh ra khi lên men rượu một lượng glucozơ được đưa vào dung dịch Ca(OH)2 dư tạo nên 40 gam kết tủa. Khối lượng ancol etylic thu được là
Đáp án khuyên bảo giải
Ta có: n
CO2 = 40/100 = 0,4 mol
Phương trình hóa học
C6H12O6

=> nrượu = n
CO2 => mrượu = 0,4 . 46 = 18,4
Câu 6. tổng hợp 23,8 g muối bột M2CO3 cùng RCO3 vào HCl thấy bay ra 0,2 mol khí. Cô cạn hỗn hợp thu được từng nào gam muối hạt khan.
Đáp án chỉ dẫn giải chi tiết
Gọi số mol của M2CO3 là x, của RCO3 là y, phương trình làm phản ứng xảy ra:
M2CO3 + 2HCl → 2MCl + H2O + CO2
x → 2x → x
RCO3 + 2HCl → RCl2 + H2O + CO2
y → y → y
Ta tất cả theo phương trình (1), (2)
n
CO2 = x + y = 0,2 mol
Áp dụng cách thức tăng giảm cân nặng ta có: Δm = 11x + 11y = 11 (x + y) = 11.0,2 = 2,2 gam
Khối lượng muối khan là: m = mban đầu + Δm = 23,8 + 2,2 = 26, 0 gam
Câu 7. mang lại 40,3 gam các thành phần hỗn hợp 2 axit no đối chọi chức công dụng vừa đầy đủ với hỗn hợp Na2CO3 thì thu được V lít khí CO2 (đktc) với dung dịch muối. Cô cạn hỗn hợp thì thu được 57,92 gam muối. Tính cực hiếm thể tích khí CO2 hình thành và trọng lượng muối thu được?
Đáp án hướng dẫn giải bỏ ra tiết
Gọi công thức tổng thể trung bình của 2 axit là: R-COOH
Phương trình phản ứng hóa học:
2RCOOH + Na2CO3 → 2RCOONa + CO2 + H2O
0,8 mol → 0,4 → 0,4 → 0,4
Theo phương trình hóa học: 1 mol axit tạo ra 1 mol muối tăng: 23 - 1 = 22 g
Theo đề bài, khối lượng tăng: 57,92 - 40,3 = 17,62 gam
⇒ naxit = 17,62/22 = 0,8 mol
⇒ n
CO2 = 50% naxit = 0,4 mol ⇒ VCO2 = 0,4.22,4 = 8,96 lít
=> m
CO2 = 0,4 x 44 = 17,6 gam
m
H2O = 0,4 x 18 = 7,2
m
Na2CO3 = 0,4 x (23 x 2 + 12 + 16 x 3) = 42,4 gam
Theo phương trình bội nghịch ứng cân nặng muối chiếm được là:
Áp dụng bảo toàn cân nặng ta có:
m axit + m
Na2CO3 = m muối + m
CO2 + m
H2O
=> m muối hạt = 40,3 + 42,4 - 17,6 - 7,2
Câu 8. Đốt cháy hoàn toàn m gam hợp hóa học hữu cơ R bắt buộc dùng 22,4 gam khí oxi, chiếm được 17,6 gam CO2 cùng 10,8 gam H2O. Ở đktc 4,48 lít khí R có khối lượng 6 gam. Xác minh CTPT của R?
Hướng dẫn giải bài xích tập
Phương trình phản bội ứng tổng quát xảy ra:
A + O2 → CO2 + H2O
n
O2 = 11,2/32 = 0,7 mol;
n
CO2= 8,8/44 =0,4 mol;
n
H2O = 5,4/18 = 0,6 mol
Bảo toàn nhân tố O:
n
O trong R+ 2n
O2 = 2n
CO2 + n
H2O => n
O = 0
Vậy trong phân tử hợp chất hữu cơ R không tồn tại nguyên tố oxi
Hợp hóa học hữu cơ R chỉ chứa 2 nguyên tố là: 0,2 mol C với 0,6 mol H
→ C : H= 1:3→ (CH3)n → MR=15n
Vì 25 2H6
Câu 9: Cho hợp hóa học hữu cơ R mạch hở tất cả công thức C3Hy. Đưa hợp hóa học hữu cơ R vào một bình bao gồm dung tích không đổi chứa hỗn hợp khí X cùng O2 dư sống 150ºC, áp suất 2 atm, nhảy tia lửa điện nhằm đốt cháy R tiếp đến đưa bình về 150o
C tất cả áp suất vẫn là 2 atm. Xác minh công thức phân tử của R?
Hướng dẫn giải bài xích tập
Phương trình chất hóa học tổng quát
C3Hy + (3 + 1/4y) O2 → 3CO2 + 1/2y H2O
Theo đề bài bác do áp suất ko đổi đề xuất ta có
1 + 3 + 1/4y = 3 +1/2y => y = 4
Công thức hợp hóa học hữu cơ R là C3H4
Câu 10: Đốt cháy trọn vẹn một hợp hóa học hữu cơ X có khối lượng là 11,5 gam. Biết hợp chất hữu cơ X chỉ gồm các nguyên tố: C, H, O. Sau phản nghịch ứng nhận được 22,0 gam CO2 và 13,5 gam H2O.
a) Tính thành phần phần trăm của các nguyên tố trong X.
b) Lập công thức đơn giản và dễ dàng nhất của X.
c) Tìm cách làm phân tử của X. Biết tỉ khối tương đối của X so với khí hiđro bởi 23.
Xem thêm: Những App Học Toán Miễn Phí Cho Trẻ Từ 3, Các App Học Toán Miễn Phí Phổ Biến Nhất Hiện Nay
Hướng dẫn giải bài bác tập
Ta có
n
C = n
CO2 = 0,5 => %C = 0,5 . 12/11,5 = 52,17%
n
H= 2n
H2O = 1,5 => %H = 1,5.1/11,5 = 13,04%
=> %O = 100% -%H - %C = 34,79%
n
O= ( m
X - m
C - m
H )/16 = 0,25
Gọi cách làm hóa học của hợp hóa học hữu cơ X là Cx
Hy
Oz
=> x : y : z = n
C : n
H : n
O = 0,5 : 1,5 : 0,25 = 2 : 6 : 1
Công thức dễ dàng và đơn giản nhất: C2H6O
Công thức phân tử: (C2H6O)n
=> MX = 46n = 46
=> n = 1
Công thức hóa học X là C2H6O
...................................
Ngoài tài liệu các công thức hóa học lớp 9 Đầy đủ nhất, mời các bạn tìm hiểu thêm Giải bài tập hóa học 9, Tài liệu học hành lớp 9 và những đề thi học kì 1 lớp 9 nhưng Vn
Doc tổng hợp và đăng tải để có sự chuẩn bị cho những kì thi quan trọng sắp tới.
Ngoài ra, Vn
Vớimục đích góp học sinh dễ dàng nhớ và nắm vững nhữngcông thức của Hóa họclớp 9học kì 1,Điểm 10+đã cầm tắt bộcông thức Hóa họclớp 9giúp học viên đạt đạt điểm caotrong đề thi HK1 hóa học lớp 9sắp tới.

CHƯƠNG1: CÁC LOẠI HỢP CHẤT VÔ CƠ
I. PHÂN LOẠI HỢP CHẤT VÔ CƠ

II. OXIT
Oxitlà hợp hóa học của yếu tắc oxi với cùng một nguyên tố chất hóa học khác
CTTQ:Mx
Oy
VD: Na2O; Fe2O3
Cách call tên:
+Tên oxit axit=tên yếu tắc phi kim(kèm tiền tố chỉ số nguyên tử kim loại hoặc phi kim) +oxit(kèm chi phí tố chỉ số nguyên tử oxi)
Một số chi phí tố chỉ số nguyên tử: mono : 1; đi : 2; Tri : 3.....
VD:CO2: Cacbon dioxit
P2O5: Đi photpho penta oxit
+Tên oxit bazo=Tên nguyên tố kim loại(kèm hóa trị ví như nguyên tố kim loại có khá nhiều hóa trị) +oxit
VD:Fe2O3: fe (III) oxit
Tính chất hóa học
| Oxit axit | Oxit bazo |
a. Tính năng với nước→dung dịch axit VD: SO2+ H2O → H2SO3 b. Tính năng với dd bazo→Muối + H2O CO2+ Ca(OH)2→ Ca c. Chức năng với oxit bazo→Muối (Một số oxit bazo bao gồm thể tác dụng với oxit axit: K2O, Na2O, Ba SO2 + Ba | a. Tác dụng với nước→Dung dịch bazo (kiềm) Ba b. Chức năng với axit→Muối + Nước Fe c. Tác dụng với oxit axit→Muối SO2+ Ba |
| Oxit lưỡng tính | Oxit trung tính |
Oxit lưỡng tính vừa tác dụng với dung dịch axit, vừa công dụng với dung dịch bazo để chế tác thành muối và nước. Al2O3+ 6HCl → 2Al Al2O3+ 2Na | Oxit trung tính là các oxit không tác dụng với axit, bazo giỏi với nước VD: NO, CO, N2O,… |
III. AXIT
Axitlà hợp hóa học mà phân tử tất cả một hay những nguyên tử hidro links với gốc axit.
CTTQ: Hn
A
VD: HCl, H2SO4, HNO3, H3PO4...
Cách điện thoại tư vấn tên:
a.Axit không tồn tại oxi: thương hiệu axit =Axit + tên phi kim + hidric
VD: HCl: axit clohidric
HF: axit flohidric
b.Axit gồm oxi:Tên axit =Axit + tên phi kim + ic
VD: H2SO4: Axit sunfuric
HNO3: Axit nitric
Axit có ít nguyên tử oxi: thương hiệu axit =Axit + thương hiệu phi kim + ơ
VD: H2SO3: Axit sunfurơ
Tính hóa học hóa học
a. Đổi màu hóa học chỉ thị
Axit làm chuyển màu quỳ tím sang color đỏ
b. Tính năng với oxit bazo => muối bột + H2O
VD: H2SO4+ Ba
O → Ba
SO4+ H2O
c. Công dụng với bazo => muối + H2O
VD: 2HCl + Cu(OH)2→ Cu
Cl2+ 2H2O
d. Tác dụng với sắt kẽm kim loại => muối + H2
(dung dịch HCl, H2SO4tác dụng KL (trừ một trong những KL: Ag, Cu, ...)
H2SO4+ sắt → Fe
SO4+ H2
e. Tính năng với muối => Muối bắt đầu + axit mới
(Sản phẩm hiện ra là hóa học dễ bay hơi. Hoặc muối bắt đầu không tan)
- lưu lại ý:
Al, Fe, Crthụ độngtrongHNO3đặc nguội,H2SO4đặc nguội
H2SO4đặc nóng, HNO3tác dụng với phần nhiều các kim loại (trừ Au, Pt) vàkhôngsinh ra khí H2
Cu + H2SO4đặc → Cu
SO4+ SO2+ 2H2O
IV. BAZO
Bazolà phù hợp chất có một nguyên tử kim loại links cới một hay các nhóm hidroxit (OH)
CTTQ: M(OH)n
VD: Na
OH; Fe(OH)3
Cách hotline tên bazo:
Tên bazo=Tên yếu tắc kim loại(kèm hóa trị trường hợp nguyên tố hóa trị có không ít hóa trị) +hidroxit
VD: Fe(OH)2: fe (II) hidroxit
Na
OH: Natri hiroxit
Tính chất hóa học
-Tác dụng cùng với axit=> muối + H2O
Ca(OH)2+ H2SO4→ Ca
SO4+ 2H2O
-Bazo tanlàm đổi màu chất chỉ thị.Qùytím đưa thành màu sắc xanh, phenol phtalein chuyển thành color hồng
-Bazo tantác dụng với oxit axit => muối bột + H2O
Ba(OH)2+ CO2→ Ba
CO3+ H2O
-Bazo tantác dụng với dung dịch muối => Muối mới + Bazo mới
(ĐK: thành phầm sinh ra bắt buộc có ít nhất 1 chất kết tủa)
2Na
OH + Cu
SO4→ Cu(OH)2+ Na2SO4
-Bazo ko tanbị nhiệt độ phân diệt => Oxit bazo + H2O
Cu(OH)2t0→Cu
O + H2O
V. MUỐI
Muốilà hợp hóa học mà phân tử có một hay nhiều nguyên tử kim loại link với một hay những gốc axit
CTTQ:Ax
By
A là kim loại, B là nơi bắt đầu axit
VD: K2SO4; Ca
CO3, ...
Tên gọi:
Muối trung hòa:Tên nhân tố kim loại(kèm hóa trị giả dụ nguyên tố kim loại có nhiều hóa trị) +Tên cội axit
VD: Na2SO4: Natri sunfat
Muối axit :Tên nguyên tố kim loại + hidro + tên nơi bắt đầu axit
VD: Na
HCO3: Natri hidrocacbonat
Tính hóa học hóa học
-Dung dịch muối + kim loại→Muối bắt đầu + KL mới
VD: Cu
SO4+ fe → Fe
SO4+ Cu
-Muối + axit→Muối bắt đầu + axit mới
(Sản phẩm hình thành phải tất cả chất kết tủa, hoặc khí bay ra)
VD: Ca
CO3+ HCl → Ca
Cl2+ CO2+ H2O
-Dung dịch muối + dung dịch bazo => Muối bắt đầu + bazo mới
(Sản phẩm sinh ra yêu cầu có tối thiểu 1 chất kết tủa)
VD: Cu
SO4+ Na
OH → Cu(OH)2+ Na2SO4
-Dung dịch muối hạt + hỗn hợp muối => 2 muối bột mới
(Sản phẩm sinh ra đề nghị có tối thiểu 1 hóa học kết tủa)
VD: Na2SO4+ Ba
Cl2→ Ba
SO4+ Na
Cl
VI. Quan hệ giữa các hợp hóa học vô cơ
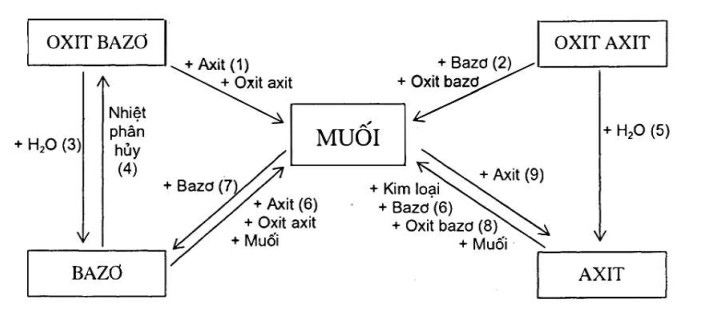
CHƯƠNG 2: KIM LOẠI
I. đặc điểm vật lý
-Tính chất chung:Tính dẻo, dẫn điện, dẫn nhiệt cùng ánh kim
-Tính chất riêng:Khối lượng riêng rẽ (D) ; ánh sáng nóng chảy, độ cứng
II. Tính chất hóa học
- chức năng với phi kim
Tác dụng với oxi => Oxit kim loại
(Trừ một số trong những kl như Ag, Au, Pt)
Fe + O2→ Fe2O3
Tác dụng cùng với phi kim không giống => Muối
Ca + Cl2→ Ca
Cl2
- công dụng với axit
+ KL + Axit (HCl ; H2SO4loãng) => muối hạt + H2
Mg + H2SO4→ Mg
SO4+ H2
+ KL + Axit (HNO3, H2SO4đ) => muối bột + sản phẩm khử + H2O
Cu + H2SO4đ → Cu
SO4+ SO2+ H2O
- chức năng với hỗn hợp muối => Muối new + KL mới
Cu + 2Ag
NO3→ Cu(NO3)2+ 2Ag
III. Dãy vận động hóa học tập của kim loại
K Na bố Ca Mg Ak Zn Fe(H)Cu Hg Ag Pt Au
Ý nghĩa dãy hoạt động hóa học của kim loại:
Đi tự trái lịch sự phải, mức độ chất hóa học của sắt kẽm kim loại giảm dầnKim các loại đứng trước Mg, phản nghịch ứng cùng với nước ở điều kiện thường tạo ra thành dung dịch kiềm giải phóng khí hidro
Kim loại đứng trước H bội phản ứng với một trong những dung dịch axit (HCl, H2SO4, ...) giải phóng khí hidro
Kim một số loại đứng trước (trừ Na, K, Ca, Ba, ...) đẩy được kim loại đứng sau ra khỏi dung dịch muối
IV. Hòa hợp kim
1. Vừa lòng kim
Là hóa học rắn thu được khi làm cho nguội tất cả hổn hợp nóng chảy của rất nhiều kim loại khác nhau hoặc của kim loại và phi kim.
| Gang | Thép |
-Ganglà kim loại tổng hợp của fe với cacbon và một số nguyên tố không giống (Mn, Si, S, ...) trong đó hàm lượng C tự 2 – 5% - bao gồm 2 nhiều loại gang: + Gang trắng dùng để luyện thép + Gang xám để sản xuất máy móc, thiết bị | -Théplà hợp kim của sắt với Cacbon, một vài nguyên tố khác trong những số ấy làm lượng C - Thép thường xuyên được dùng sản xuất máy móc, lao lý lao cồn trong xây dựng |
Sản xuất: Nguyên liệu - Quặng fe (Manhetit: Fe3O4; Hemantit: Fe2O3,...) - Than cốc, không khí, ... Dùng co khử các oxit fe ở ánh nắng mặt trời cao vào lò luyện kim. Qúa trình sản xuất: - bội phản ứng sinh sản CO: C + O2t0→ CO2 C + CO2t0→ 2CO - Khử oxit sắt Fe2O3+ 3COt0→ 2Fe + 3CO2 Fe3O4+ 3COt0→ 3Fe + 4CO2 - sinh sản xỉ: Ca | Sản xuất: Nguyên liệu: - Gang; - Sắt phế liệu - Khí oxi - vẻ ngoài sản xuất: Oxi hóa các kim loại, phi kim để loại khỏi gang phần nhiều các nhân tố C, S, P, Mn, Si, … Qúa trình sản xuất: - bội phản ứng sinh sản Fe 2Fe + O2t0→ 2Fe - Fe Fe |
V. SỰ ĂN MÒN KIM LOẠI VÀ BẢO VỆ KIM LOẠI KHÔNG BỊ ĂN MÒN
1. Sự bào mòn kim loại
Sự tiêu diệt kim loại và kim loại tổng hợp trong môi trường tự nhiên do tính năng hóa học hotline làsự bào mòn kim loại
2. Phần lớn yếu tố tác động đến sự ăn mòn kim loại
- nhiệt độ độ:Nhiệt độ cao, bào mòn nhanh
- những chất vào môi trường: ẩm, những chất OXH thì làm mòn nhanh
3. Những phương pháp bảo đảm kim loại không bị ăn mòn
- Ngăn quán triệt kim loạitiếp xúcvới môi trường xung quanh
- sản xuất các kim loại tổng hợp có khả năngchống, chịu nạp năng lượng mòn
CHƯƠNG 3: PHI KIM
I. TÍNH CHẤT VẬT LÝ CỦA PHI KIM
- Ở điều kiện thường, những phi kim tồn tại làm việc cả 3 trạng thái: rắn, lỏng, khí.
- đa số các phi kim không dẫn điện, dẫn sức nóng kém, không có ánh kim
- một trong những phi kim độc như: Cl2, Br2, I2, ...
II. TÍNH CHẤT HÓA HỌC
1. Chức năng với sắt kẽm kim loại => muối bột (hoặc oxit)
VD: Hg + S → Hg
S
2. Công dụng với hidro => Hợp hóa học khí
VD: H2+ Cl2→ 2HCl
3. Nút độ hoạt động của phi kim
Mức độ hoạt động hóa học mạnh khỏe hay yếu của các phi kim xét phụ thuộc khả năng tính năng của phi kim với sắt kẽm kim loại và hidro









