Chủ đề công thức tính số mol mới: Số mol là một trong những khái niệm quan trọng đặc biệt trong nghành nghề dịch vụ hóa học. Có rất nhiều cách tính số mol, như tính qua thể tích hoặc tính qua khối lượng. Một phương pháp tính đơn giản dễ dàng là sử dụng công thức n = V/22.4, trong số ấy V là thể tích dung dịch. Đây là một trong những công thức thuận lợi và sử dụng thông dụng trong việc đo lường và tính toán số mol.
Bạn đang xem: Công thức hóa tính số mol
Công thức tính số mol mới có thể áp dụng cho những trường hợp khi họ cần tính số mol của một chất sau thời điểm thực hiện những phản ứng hóa học hoặc các quá trình khác. Để tính số mol mới, bạn có thể sử dụng các công thức sau:1. Tính số mol tự khối lượng:- thực hiện công thức n = m/M, trong những số đó n là số mol, m là cân nặng của chất (đơn vị gam), và M là khối lượng mol của chất. Bí quyết này tương quan đến nguyên tắc Avogadro, trong số ấy M là khối lượng mol của hóa học (được xác minh bằng khối lượng molar của hóa học đó).2. Tính số mol từ bỏ thể tích:- Nếu họ biết thể tích của chất (đơn vị lit), chúng ta cũng có thể tính số mol bằng công thức n = V/Vm, trong những số đó n là số mol, V là thể tích của chất và Vm là thể tích mol của chất. Thể tích mol của chất thuộc loại khí ở đk tiêu chuẩn là 22.4 lit/mol.3. Tính số mol từ nồng độ:- Nếu chúng ta biết nồng độ của chất (đơn vị mol/lit), chúng ta có thể tính số mol bằng công thức n = C.V, trong đó n là số mol, C là độ đậm đặc của hóa học và V là thể tích hóa học đó.Bạn rất có thể áp dụng bí quyết tính số mol mới cho những trường hòa hợp khác nhau, bao gồm trong các phản ứng hoá học, thống kê giám sát nồng độ của các dung dịch, xác định số mol của các chất vào một láo lếu hợp, và nhiều trường hợp khác.

Cách tính số mol qua thể tích là cách thức giúp bọn họ xác định số mol của một chất dựa trên thông tin về thể tích của chất đó. Công thức tính số mol qua thể tích như sau: n = V/Vm.Trong đó:- n là số mol của chất.- V là thể tích của chất (đơn vị buộc phải thống nhất, ví dụ: lít).- Vm là thể tích molar chuẩn của chất (đơn vị: lít/mol).Để áp dụng công thức này, ta cần phải biết giá trị của V và Vm.Có một số trong những quy tắc và bí quyết cần chú ý khi tính số mol qua thể tích:1. Đầu tiên, họ cần biết không gian của chất, hoàn toàn có thể được mang lại trong đề bài xích hoặc được đo bằng thiết bị đo lường.2. Tiếp theo, ta cần khẳng định thể tích molar chuẩn chỉnh của chất. Thể tích molar chuẩn chỉnh (Vm) của một chất được khẳng định là 22.4 lít/mol so với chất khí ở điều kiện tiêu chuẩn (nhiệt độ 0 độ Celsius với áp suất 1 atm).3. Sau đó, triển thi công thức tính số mol qua thể tích: n = V/Vm. Thực hiện phép tính để xác minh giá trị của số mol.Ví dụ: trả sử bọn họ có một hóa học khí có thể tích là 5 lít. Để tính số mol của chất này, ta sử dụng công thức n = V/Vm. Với hóa học khí ở điều kiện tiêu chuẩn, thể tích molar chuẩn chỉnh (Vm) là 22.4 lít/mol. Áp dụng công thức, ta tất cả n = 5/22.4 = 0.223 mol.Chính bởi vì vậy, số mol của chất khí trong lấy ví dụ trên là 0.223 mol.Tóm lại, phương pháp tính số mol qua thể tích mang đến phép bọn họ xác định số mol của một chất dựa trên tin tức về thể tích của hóa học đó. Bằng cách sử dụng phương pháp n = V/Vm với áp dụng những giá trị phù hợp hợp, ta rất có thể tính toán số mol một cách bao gồm xác.
Nồng độ mol là một trong đại lượng đo lường sự triệu tập của một chất trong một dung dịch. Nó được xem bằng lượng chất (g hoặc mol) chia cho thể tích dung dịch (L hoặc m
L).Để tính số mol, họ sử dụng cách làm n = m/M hoặc n = V/v trong đó:- n là số mol- m là khối lượng của chất (g)- M là trọng lượng mol của chất (g/mol)- V là thể tích hỗn hợp (L hoặc m
L)- v là thể tích mol của hóa học (L/mol)Cách tính số mol thông qua khối lượng chất (m):1. Xác định khối lượng của hóa học trong đơn vị gam (m).2. Tìm khối lượng mol của chất (M) trải qua bảng tuần trả hoặc trải qua công thức phân tử của chất.3. Sử dụng công thức n = m/M để tính số mol.Cách tính số mol thông qua thể tích hỗn hợp (V):1. Xác định thể tích của hỗn hợp trong đơn vị L hoặc m
L (V).2. Kiếm tìm thể tích mol của hóa học (v) trải qua bảng tuần trả hoặc thông qua công thức phân tử của chất.3. Thực hiện công thức n = V/v nhằm tính số mol.Ví dụ:1. Tính số mol của 10g Na
Cl trong 5000 m
L hỗn hợp (V = 5000 m
L).- Xác định trọng lượng của chất: m = 10g- Tìm cân nặng mol của Na
Cl: M(Na
Cl) = 58.5 g/mol- áp dụng công thức n = m/M: n = 10g/58.5 g/mol = 0.17 mol2. Tính số mol của dung dịch bao gồm 30 m
L H2SO4 (V = 30 m
L).- xác định thể tích của dung dịch: V = 30 m
L- kiếm tìm thể tích mol của H2SO4: v(H2SO4) = 1L/mol (theo bí quyết phân tử H2SO4)- thực hiện công thức n = V/v: n = 30 m
L/1L/mol = 0.03 mol
Như vậy, nồng độ mol là một cách để đo lường sự tập trung của một chất và ta có thể tính số mol thông qua cân nặng chất hoặc thể tích dung dịch.

Để tìm nồng độ của dung dịch đựng 10 gam Na
Cl vào 5 L dung dịch, ta sử dụng công thức tính số mol như sau:Bước 1: Xác định cân nặng mol của Na
Cl.Khối lượng mol của Na
Cl là 58.44 g/mol. (Na có cân nặng nguyên tử 22.99 g/mol cùng Cl có khối lượng nguyên tử 35.45 g/mol).Bước 2: Tính số mol Na
Cl trong dung dịch.Số mol Na
Cl = cân nặng Na
Cl / khối lượng mol Na
Cl.Số mol Na
Cl = 10 g / 58.44 g/mol.Bước 3: Tính mật độ mol của dung dịch.Nồng độ mol = số mol Na
Cl / thể tích dung dịch.Nồng độ mol = (10 g / 58.44 g/mol) / 5 L.Bước 4: giám sát và đo lường và đơn vị chức năng hóa kết quả.Thực hiện các phép tính nhằm tìm cực hiếm nồng độ mol của dung dịch.Sau khi tính toán, mật độ mol của dung dịch đựng 10 gam Na
Cl trong 5 L dung dịch sẽ là tác dụng cuối cùng.Ví dụ: nếu như ta sử dụng giá trị trọng lượng mol nhằm tính, độ đậm đặc mol của dung dịch sẽ là (10 g / 58.44 g/mol) / 5 L = 0.034 mol/L.Vậy nồng độ mol của dung dịch cất 10 gam Na
Cl trong 5 L hỗn hợp là khoảng 0.034 mol/L.
Hướng dẫn Tính khối lượng, Tính thể tích chất khí, Tính số mol
Sự tính khối lượng là một khái niệm đặc biệt trong công nghệ và toán học. Clip này để giúp bạn làm rõ hơn về cách đo lường và giám sát và đo lường khối lượng, tự các phương thức cơ bạn dạng đến ứng dụng thực tiễn.

Để tính số mol từ cân nặng mẫu, bọn họ cần biết cân nặng mẫu và khối lượng mol của hóa học đó. Bí quyết để tính số mol từ cân nặng mẫu là: số mol = khối lượng mẫu / khối lượng mol.Bước 1: Xác định khối lượng mẫu.- Nếu đã biết khối lượng mẫu, ta thực hiện giá trị đó nhằm tính số mol.- Nếu không biết khối lượng mẫu còn chỉ có thông tin về thể tích hoặc nồng độ, ta yêu cầu sử dụng các công thức khác nhằm tìm khối lượng mẫu trước lúc tính số mol.Bước 2: Xác định khối lượng mol.- trọng lượng mol của một chất được xem bằng tổng khối lượng của tất cả các nguyên tử hoặc các phân tử trong một mol của chất đó. Trọng lượng mol thường xuyên được cung cấp trong bảng tuần hoàn các nguyên tử.Bước 3: Tính số mol.- Chia khối lượng mẫu cho trọng lượng mol nhằm tính số mol.- công dụng sẽ là số mol của hóa học đó trong mẫu.Ví dụ: trường hợp ta bao gồm một mẫu nhôm có cân nặng 27 gram và trọng lượng mol của nhôm là 26.98 gram/mol, ta sử dụng công thức số mol = khối lượng mẫu / khối lượng mol.Số mol = 27 g / 26.98 g/mol = 1.001 mol (đã được thiết kế tròn).Chú ý: Khi sử dụng công thức này, hãy bảo vệ cùng đơn vị cho cả cân nặng mẫu và trọng lượng mol để thống kê giám sát chính xác.
Công thức tính số mol mới áp dụng cho trường phù hợp nào?
Công thức tính số mol mới được áp dụng trong trường hợp chuyển đổi từ khối lượng (g) hoặc thể tích (L) thành số mol.1. Đối với biến hóa từ khối lượng (g) sang số mol:- Đầu tiên, ta phải ghi nhận được cân nặng của hóa học đó.- Tiếp theo, ta thực hiện công thức sau: số mol (mol) = khối lượng (g) / trọng lượng mol (g/mol).- trong đó, khối lượng mol là khối lượng molar của hóa học đó, được tìm thấy trong bảng tuần hoàn những nguyên tố.2. Đối với thay đổi từ thể tích (L) thanh lịch số mol:- vào trường đúng theo này, ta phải biết được thể tích của chất đó.- Sau đó, ta sử dụng công thức sau: số mol (mol) = thể tích (L) / thể tích mol (L/mol).- Thể tích mol là thể tích molar của hóa học đó, có thể được kiếm tìm thấy trong thông số về khí lý tưởng (như ở điều kiện tiêu chuẩn) là 22.4 L/mol.Vì vậy, công thức tính số mol mới áp dụng cho ngôi trường hợp biến hóa từ cân nặng hoặc thể tích quý phái số mol, và nhờ vào vào thông tin thuở đầu có sẵn về khối lượng hoặc thể tích của hóa học đó.
Công thức tính số mol mới, Cánh diều, liên kết tri thức, chân trời sáng tạo
Cánh diều là một trong những loại đồ đùa vui nhộn cùng thú vị. Trong video clip này, các bạn sẽ được mày mò những kỹ thuật và bí quyết để bay cánh diều một cách dễ dãi và thành công. Hãy tận cùng hưởng niềm vui của việc tinh chỉnh và điều khiển cánh diều cất cánh lên trời!
Mol - bài 18 - hóa học 8 - Cô Nguyễn Thị Thu
Mol là một trong đơn vị đo lường đặc trưng trong hóa học. Video clip này để giúp bạn làm rõ hơn về có mang và áp dụng của mol trong các phản ứng hóa học, từ giám sát đến cách áp dụng để tạo nên các cấu tạo từ chất hữu ích.
Cách đổi khác từ gam quý phái số mol trong công thức tính số mol new như sau:1. Xác định khối lượng của chất đề nghị tính số mol, được call là m (đơn vị: gam).2. Xác định trọng lượng mol tử (MT) của hóa học đó, được biết thông qua bảng tuần trả nguyên tố. MT được xem bằng tổng trọng lượng của toàn bộ các nguyên tử trong phân tử.3. Thực hiện công thức tính số mol: số mol (n) = m / MT.4. Triển khai phép tính để đo lường số mol thiết yếu xác.
Công thức tính số mol bắt đầu sẽ có ảnh hưởng đến mật độ của hỗn hợp theo phương pháp tính sau:1. Đầu tiên, họ cần biết bí quyết tính số mol new được sử dụng. Ví dụ, công thức cơ bản để tính số mol là n = m/M, trong các số đó n là số mol, m là cân nặng chất cùng M là trọng lượng mol của hóa học đó.2. Sau đó, chúng ta cần biết thể tích hỗn hợp để giám sát và đo lường nồng độ. Ví dụ, nếu bọn họ biết thể tích hỗn hợp là V (thường được tính bằng lít), ta rất có thể tính mật độ mol bởi công thức cơ bản là C = n/V, trong số đó C là mật độ mol.3. Khi tất cả công thức tính số mol new và mật độ ban đầu, ta hoàn toàn có thể áp dụng phương pháp tính số mol bắt đầu vào cách làm tính độ đậm đặc để đo lường nồng độ mol bắt đầu của dung dịch. Điều này có thể được thực hiện bằng phương pháp thay cầm cố số mol thuở đầu bằng số mol mới vào cách làm và đo lường nồng độ mới.Ví dụ, mang sử lúc đầu ta gồm một dung dịch với số mol là n1 và nồng độ mol ban sơ là C1. Sau khi đo lường và tính toán số mol new là n2 bằng công thức cung cấp, ta có thể thay ráng n2 vào phương pháp tính độ đậm đặc và thống kê giám sát nồng độ mol mới là C2.Với việc áp dụng công thức tính số mol new và thống kê giám sát nồng độ mol mới, bạn cũng có thể đánh giá chỉ được sự tác động của bí quyết này cho nồng độ của dung dịch.
Công thức tính số mol mới trong những phản ứng hóa học có tương đối nhiều lợi ích quan tiền trọng. Dưới đây là một số lợi ích của cách làm tính số mol mới trong số phản ứng hóa học:1. Xác định tỷ lệ mol: cách làm tính số mol mới giúp chúng ta xác định xác suất số mol của những chất gia nhập trong phản bội ứng. Điều này rất đặc biệt để đo lường số lượng chất quan trọng và sản phẩm được tạo nên trong một làm phản ứng hóa học.2. Tính toán khối lượng chất: bằng cách biết số mol của một chất, chúng ta cũng có thể tính toán khối lượng của nó bằng cách nhân số mol với khối lượng molar (khối lượng của một mol chất). Điều này mang lại phép họ dễ dàng xác định cân nặng cần thiết hoặc nhận được trong một phản bội ứng hóa học.3. Thẩm tra phản ứng: bí quyết tính số mol mới cung ứng cho chúng ta một phương pháp để kiểm tra tính đúng chuẩn của những phản ứng hóa học. Bằng cách tính toán số mol trước với sau làm phản ứng, chúng ta cũng có thể kiểm tra coi liệu yêu cầu tồn tại một sự mất mát hay lợi hay không. Nếu tỷ lệ số mol không giống nhau trước với sau phản bội ứng, hoàn toàn có thể xảy ra lỗi trong quy trình thực hiện phản ứng.4. Định lượng hóa học trong dung dịch: cách làm tính số mol mới hỗ trợ cho chúng ta một phương pháp để xác định độ đậm đặc của một hóa học trong một dung dịch. Bằng phương pháp biết số mol và thể tích của dung dịch, chúng ta cũng có thể tính toán độ đậm đặc của chất đó. Điều này rất bổ ích trong câu hỏi phân tích chất hóa học và khẳng định thành phần của những dung dịch.Tóm lại, cách làm tính số mol mới là 1 trong công cụ đặc biệt trong hóa học để đo lường và thống kê tỷ lệ số mol, cân nặng chất, khám nghiệm tính đúng đắn của phản bội ứng cùng định lượng chất trong dung dịch. Sự thực hiện công thức này giúp chúng ta hiểu rõ rộng về các quy hình thức và quy tắc của những phản ứng hóa học và áp dụng chúng nó vào việc nghiên cứu và phân tích và triển khai các phản ứng chất hóa học một cách đúng mực và hiệu quả.
Khi làm quen với môn hóa học, có lẽ rằng số mol, nồng độ mol là hầu hết thuật ngữ mà những em học sinh sẽ bắt gặp rất nhiều trong số bài học. Cùng đó cũng đó là những kiến thức đầu tiên mà những em phải nắm rõ để ban đầu bước vào chinh phục môn hóa học. Vậy mol, độ đậm đặc mol là gì? Cách tính số mol ra sao? Hãy thuộc Lab
VIETCHEM đi tìm hiểu những kỹ năng và kiến thức thú vị về số mol qua nội dung bài viết sau phía trên nhé!

Cách tính số mol
Mol là gì?

Mol là gì?
Trước khi tò mò cách tính số mol, họ cần phải biết được định nghĩa mol là gì?
- Theo wikipedia, Mol hay mole (ký hiệu: mol), là solo vị giám sát dùng trong hóa học nhằm mô tả lượng chất tất cả chứa 6,022.1023 số hạt đơn vị chức năng nguyên tử hoặc phân tử chất đó. Số 6,02214129(27)×1023 - được hotline là hằng số Avogadro (ký hiệu NA), như 1 mol sắt - sắt hay 6.1023 nguyên tử Fe.
- Mol là 1 trong trong những đơn vị cơ bản của hệ SI cho các hạt vi mô.Trong các phép biến hóa các đại lượng, ta hoàn toàn có thể làm tròn: N = 6,023.1023.
- Tùy vào vấn đề lựa chọn hạt đơn vị chức năng mà mol được phân thành hai loại, bao gồm mol nguyên tử và mol phân tử.
+ Mol nguyên tử của một yếu tắc chính là lượng nguyên tố đó gồm chứa NA nguyên tử hóa học nguyên tố đó, như mol nguyên tử kali sẽ sở hữu 6,02×1023 nguyên tử K.
+ Mol phân tử của một chất đó là lượng chất của NA phân tử của chất đó như 1 mol phân tử oxy sẽ có 6,022×1023 phân tử khí oxy.
Nồng độ mol là gì?

Nồng độ mol là gì?
Trong dung dịch có chứa cả hóa học tan và hóa học không tan. Lượng hóa học tan trong luôn thể tích dung môi thắt chặt và cố định càng lớn thì mật độ càng cao. Mật độ này vẫn đạt giá trị cực lớn khi dung dịch bão hòa tức chất tan gần như là không thể hòa tan cung cấp dung dịch được nữa. Ví như vẫn nạm thêm chất tan vào, hiện tượng lạ phân tử bị kết tinh đã xảy ra, dẫn đến những pha thuộc tồn tại hoặc sinh sản thể vấn (huyền phù)
- mật độ mol thể tích (M) (nồng độ phân tử gam) thể hiện số mol của một hóa học tan đến trước trong một lít dung dịch như vào 5 lít dung dịch bao gồm chứa 3 mol hạt tan tạo thành dung dịch 0,6 M, còn gọi là 0,6 phân tử gam. Sử dụng mol có rất nhiều ưu điểm do nó chất nhận được đo số hoàn hảo các hạt tất cả trong dung dịch, bất kể trọng lượng và thể tích của chúng.
- mật độ molan hay nồng độ mol khối lượng (m) biểu lộ số mol của một chất cho trước trong một kg dung môi như 4 kg dung môi chứa 3 mol hạt tan, chế tạo ra thành dung dịch gồm nồng độ 0,75 mol/kg, còn được gọi là "0,75 molal."
- nồng độ mol khối lượng bất đổi mới theo ánh sáng và có tương tác với trọng lượng dung môi hơn là thể tích dung dịch. Vị đó, độ đậm đặc mol trọng lượng là một hằng số bất định, không phụ thuộc vào vào ánh sáng và áp suất. Còn với mật độ mol thể tích, nó sẽ tăng khi ánh sáng giảm.
Xem thêm: Top 10 Bài Văn Ước Mơ (Hay Nhất), Nghị Luận Về Ước Mơ (33 Mẫu)
Các cách tính số mol

Các phương pháp tính số mol nguyên tử, phân tử
+> cách tính số mol nguyên tử, phân tử theo khối lượng
n = m/M
trong đó:
n là số mol hóa học (mol).M là cân nặng mol (g/mol): Là trọng lượng mol của hóa học đó tính ra gam của N phân tử hoặc nguyên tử hóa học đó. Trọng lượng mol có mức giá trị bằng phân tử khối hoặc phân tử khối của chất đó như cân nặng mol nguyên tử cacbon – C là 12 g/mol, cân nặng mol của phân tử amoniac – NH3 là 17 g/mol.Các các bạn cần để ý rằng, khối lượng mol của nguyên tử với phân tử là không giống nhau. Ví dụ, khối lượng mol của phân tử Nito – N2 là 28 g/mol còn khối lượng mol của nguyên tử Nito – N là 14 g/mol
m là cân nặng của hóa học đó (g).+> phương pháp tính số mol của hóa học khí ở đk tiêu chuẩn chỉnh (đktc)
- Thể tích mol của các chất khí sinh hoạt cùng điều kiện nhiệt độ và áp suất là bởi nhau
- 1mol chất khí có thể tích 22,4 lít ngơi nghỉ 0 độ C, 1atm có nghĩa là VH2 = VO2 = VSO2 = VN2 = 22,4 lít.
- 1 mol chất khí có thể tích 24 lít ở đk phòng là trăng tròn độ C, 1 atm.
công thức tính số mol hóa học khí (đktc)
n = V/22,4
trong đó
n là số mol hóa học khí (mol). V là thể tích hóa học khí ở điều kiện tiêu chuẩn chỉnh (lít). 22,4 là hằng số trong điều kiện tiêu chuẩn.Đối với ngôi trường hợp chất khí làm việc trạng thái tự nhiên, điều kiện khác với điều kiện tiêu chuẩn, bạn không thể thực hiện công thức trên cơ mà phải đề xuất tới những phương pháp và phép tính phức tạp hơn.
Cách tính số mol dư
Dạng câu hỏi có hóa học dư sau phả ứng. Vấn đề sẽ cho thấy lượng của 2 chất tham gia phản ứng và yêu cầu tính lượng hóa học được tạo thành. Trong những 2 hóa học tham gia sẽ có một chất phản ứng hết, chất sót lại có thể.
Các cách giải việc tính số mol dư:
B1: Tính số mol (đổi lượng hóa học đề bài xích cho ra số mol).
B2: Viết và thăng bằng phương trình hóa học:
a
A + b
B → c
C + d
D
B3: So sánh tỉ lệ:
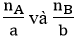
A, n
B lần lượt là số mol của A với B)
+

+

+

Tính lượng các chất theo hóa học phản ứng hết.
Công thức: Số mol (dư) = toàn bô mol ban sơ – tổng số mol đang phản ứng
Lưu ý: Với những bài xích toán cho cả lượng hóa học tham gia và lượng chất sản phẩm thì sẽ giám sát và đo lường theo lượng hóa học sản phẩm.
Bài tập tính số mol, nồng độ mol
Ví dụ 1:
Cho 3,9 gam Kali vào hỗn hợp HCl dư. Tính thể tích khí hydro chiếm được ở đk chuẩn.
Lời giải:
Phản ứng xảy ra theo 2 phương trình
2K + 2HCl → 2KCl + H2 ↑ (1)
2K + 2H2O → 2KOH + H2 ↑ (2)
Số mol Kali: n
K = 3,9/39 = 0,1 mol
Theo phương trình phản bội ứng (1) với (2), n
H2 = n
K = 0,1 mol
Vậy thể tích khí hydro thu được ở điều kiện tiêu chuẩn chỉnh là: VH2 = 0,1 x 22,4 = 2,24 lít.
Ví dụ 2:
Tính nồng độ mol của 5 lít dung dịch tất cả chứa 0,5 mol Na
Cl.
Lời giải:
Nồng độ mol sẽ tiến hành tính như sau:
CM = 0,5/5 = 0,1M
Ví dụ 3 : Tính độ đậm đặc mol của dung dịch khi hòa tan 15,8g KMn
O4 trong 5 lít nước.
Lời giải:
Số mol của KMn
O4 là: n
KMn
O4 = 15,8/158 =0,1 (mol)
Nồng độ mol của dung dịch: centimet = 0,1/5 =0,02M
Ví dụ 4: trong 100ml dung dịch có hòa rã 8 gam Na
OH. Tính độ đậm đặc mol của dung dịch.
Lời giải :
Ta có V = 100ml = 0,1 lít
n
Na
OH = 8/40 = 0,2 mol
Áp dụng công thức trên ta có:
CM = n/V =0,2/0,1= 2M
Ví dụ 4: Tính trọng lượng chất tan gồm trong 600ml dung dịch Cu
SO4 có nồng độ mol là 1,5M
Lời giải:
Ta gồm V = 500 ml = 0,5 lít
Áp dụng công thức CM = n/V => n
Cu
SO4 = V x cm = 0,5 x 1,2 =0,6 (mol)
Khối lượng Đồng sunfat Cu
SO4: n
Cu
SO4 x MCu
SO4 = 0,6 x 160 = 96 (g)
Ví dụ 5: Đốt cháy 6,2(g) phường trong bình chứa 6,72(l) khí O2 ở đktc theo sơ đồ dùng phản ứng sau
P + O2 → P2O5
Hỏi: Sau phản ứng chất nào còn dư cùng nếu dư thì với cân nặng bao nhiêu?
– Giải:
Bước 1. Tính số mol của những chất gia nhập phản ứng.
n
P = 6,2 : 31 = 0,2 (mol)
n
O2 = 6,72 : 22,4 = 0,3 (mol)
Bước 2. Thăng bằng phương trình hóa học.
4P + 5O2 → 2P2O5
4 5 2
Bước 3. nhờ vào phương trình làm phản ứng với tỉ lệ, tìm tỉ lệ số mol và hệ số phản ứng của 2 hóa học tham gia theo phương trình làm phản ứng.
n
P : 4 = 0,2 : 4 = 0.05
n
O2 : 5 = 0,3 : 5 = 0.06
Ta có tỉ lệ bội phản ứng: n
P : 4
=> p. Phản ứng hết, O2 còn dư.
=> Phương trình tính theo số mol P.
=> n
O2 phản ứng = (0.2 x 5) : 4 = 0,25 (mol)
=> Số mol O2 dư = 0,3 – 0,25 = 0,05 (mol)
Hy vọng với những thông tin mà Lab
VIETCHEM share ở trên, các em đã có câu vấn đáp cho câu hỏi mol là gì? mật độ mol là gì? phương pháp tính số mol như vậy nào?. Chúc những em học hỏi và chia sẻ được những kiến thức hữu ích nhất để học tập tốt.
Công thức tính nồng độ phần trăm (C%), mol (CM) và bài tập áp dụng
Cách tính đương lượng với định khí cụ đương lượng vào hóa học
Phương trình nhiệt độ phân KCl
O3 (muối Kali Clorat)
Tìm kiếm liên quan:
công thức tính the tích chất hóa học 10công thức tính thể tích dung dịchcông thức tính khối lượng dung dịchcông thức tính phần trăm số mol








