Bảng nguyên tố chất hóa học lớp 7 là tài liệu cực kỳ hữu ích, hướng dẫn các em học viên biết bí quyết gọi tên những nguyên tố hóa học theo danh pháp nước ngoài (IUPAC). Bảng nguyên tố hóa học liệt kê các nguyên tố chất hóa học thành dạng bảng, dựa vào số hiệu nguyên tử (số proton trong hạt nhân), thông số kỹ thuật electron và các đặc thù hóa học tập tuần hoàn của chúng.
Bạn đang xem: Bảng tuần hoàn hóa học lớp 7
Nguyên tắc sắp xếp những nguyên tố hóa học
- Năm 1869, nhà bác bỏ học fan Nga D. I. Mendeleev đã xây dừng bảng tuần hoàn theo chiều tăng dần cân nặng nguyên tử.
- những nhà khoa học hiện đại đã minh chứng rằng điện tích hạt nhân nguyên tử new là cửa hàng để gây ra bảng tuần hoàn.
- hiện tại nay, bảng tuần hoàn các nguyên tố hoá học gồm 118 nguyên tố được xuất bản theo chế độ sau:
Các nguyên tố hóa học được thu xếp theo chiều tăng mạnh của năng lượng điện hạt nhân.Các nguyên tố chất hóa học trong và một hàng bao gồm cùng số lớp electron vào nguyên tử.Các nguyên tố chất hóa học trong cùng một cột có đặc thù hóa học gần giống nhau.Xem thêm: Hóa 8 Bài Tập Cân Bằng Phương Trình Hóa Học Lớp 8 Có Lời Giải
Bảng thành phần hóa học
| Số hiệu nguyên tử (Z) | Tên cũ | Tên nguyên tố chất hóa học (IUPAC) | Kí hiệu hoá học | Khối lượng yếu tố (amu) | Hoá trị |
| 1 | Hiđro | Hydrogen | H | 1 | I |
| 2 | Heli | Helium | He | 4 | |
| 3 | Liti | Lithium | Li | 7 | I |
| 4 | Beri | Beryllium | Be | 9 | II |
| 5 | Bo | Boron | Bo | 11 | III |
| 6 | Cacbon | Carbon | C | 12 | IV, II |
| 7 | Nitơ | Nitrogen | N | 14 | II, III, IV… |
| 8 | Oxi | Oxygen | O | 16 | II |
| 9 | Flo | Flourine | F | 19 | I |
| 10 | Neon | Neon | Ne | trăng tròn | |
| 11 | Natri | Sodium | Na | 23 | I |
| 12 | Magie | Magnesium | Mg | 24 | II |
| 13 | Nhôm | Aluminium | Al | 27 | III |
| 14 | Silic | Silicon | đắm đuối | 28 | IV |
| 15 | Photpho | Phosphorus | p. | 31 | III, V |
| 16 | sulfur | Sulfur | S | 32 | II, IV, VI |
| 17 | Clo | Chlorine | Cl | 35,5 | I,… |
| 18 | Agon | Argon | Ar | 39,9 | |
| 19 | Kali | Potassium | K | 39 | I |
| 20 | Canxi | Calcium | Ca | 40 | II |
Chú thích:
Nguyên tố phi kim: chữ màu xanhNguyên tố kim loại: chữ màu sắc đen
Nguyên tố khí hiếm: chữ color đỏ
Bảng tuần hoàn các nguyên tố chất hóa học lớp 7
Bảng phiên âm tên thường gọi của đôi mươi nguyên tố hóa học đầu
Số hiệu nguyên tử (Z) | Kí hiệu hóa học | Tên yếu tố hóa học | Phiên âm Quốc tế |
1 | H | Hydrogen | /ˈhaɪdrədʒən/ |
2 | He | Helium | /ˈhiːliəm/ |
3 | Li | Lithium | /ˈlɪθiəm/ |
4 | Be | Beryllium | /bəˈrɪliəm/ |
5 | B | Boron | /ˈbɔːrɒn/ /ˈbɔːrɑːn/ |
6 | C | Carbon | /ˈkɑːbən/ /ˈkɑːrbən/ |
7 | N | Nitrogen | /ˈnaɪtrədʒən/ |
8 | O | Oxygen | /ˈɒksɪdʒən/ /ˈɑːksɪdʒən/ |
9 | F | Fluorine | /ˈflɔːriːn/ /ˈflʊəriːn/ /ˈflɔːriːn/ /ˈflʊriːn/ |
10 | Ne | Neon | /ˈniːɒn/ /ˈniːɑːn/ |
11 | Na | Sodium | /ˈsəʊdiəm/ |
12 | Mg | Magnesium | /mæɡˈniːziəm/ |
13 | Al | Aluminium | /ˌæljəˈmɪniəm/ /ˌæləˈmɪniəm/ /ˌæljəˈmɪniəm/ /ˌæləˈmɪniəm/ |
14 | Si | Silicon | /ˈsɪlɪkən/ |
15 | P | Phosphorus | /ˈfɒsfərəs/ /ˈfɑːsfərəs/ |
16 | S | Sulfur | /ˈsʌlfə(r)/ /ˈsʌlfər/ |
17 | Cl | Chlorine | /ˈklɔːriːn/ |
18 | Ar | Argon | /ˈɑːɡɒn/ /ˈɑːrɡɑːn/ |
19 | K | Potassium | /pəˈtæsiəm/ |
20 | Ca | Calcium | /ˈkælsiəm/ |
Bài ca hóa trị hay, dễ dàng học nhất
Bài ca hóa trị 1
Kali (K), Iot (I), Hidrô (H)Natri (Na) với bạc bẽo (Ag), Clo (Cl) một loài
Là hoá trị I hỡi ai
Nhớ ghi mang đến kỹ khỏi hoài phân vân
Magiê (Mg), Kẽm (Zn) với Thuỷ Ngân(Hg)Oxi (O), Đồng (Cu), Thiếc(Sn) thêm phần
Bari (Ba) sau cuối thêmchú can xi (Ca)Hoá trị II nhớ gồm gì khó khăn khăn
Bác Nhôm (Al) hoá trị III lần
In sâu tâm trí khi cần có ngay
Cacbon (C), Silic (Si) này đây
Có hoá trị IV không ngày nào quên
Sắt (Fe) cơ lắm dịp hay phiền
II, III tăng lên và giảm xuống nhớ tức tốc ngay thôi
Nitơ (N) băn khoăn nhất đời
I, II, III, IV khi thời lên VLưu huỳnh (S) lắm khi chơi khăm
Xuống II lên VI lúc nằm lắp thêm IVPhot pho (P) kể đến không dư
Có ai hỏi cho thì ừ rằng VEm ơi, nỗ lực học chăm
Bài ca hoá trị suốt năm phải dùng.
Bài ca hóa trị 2
Hidro (H) cùng rất liti (Li)Natri (Na) cùng rất kali (K) chẳng rời
Ngoài ra còn tệ bạc (Ag) sáng sủa ngời
Chỉ với hoá trị I thôi chớ nhầm
Riêng đồng (Cu) cùng với thuỷ ngân (Hg)Thường II không nhiều I chớ lần chần gì
Đổi cầm II , IV là chì (Pb)Điển hình hoá trị của chì là IIBao giờ thuộc hoá trị IILà ôxi (O) , kẽm(Zn) chẳng sai chút gì
Ngoài ra còn có canxi (Ca)Magiê (Mg) cùng rất bari (Ba) một nhà
Bo (B) , nhôm (Al) thì hóa trị IIICacbon (Ca) Silic (Si) thiếc (Sn) là IV thôi
Thế nhưng yêu cầu nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II lo liệu bộn bề
Không bền nên dễ trở nên liền fe IIIPhốtpho III ít chạm chán mà
Photpho V chính bạn ta gặp nhiều
Nitơ (N) hoá trị bao nhiêu ?
I , II, III , IV hầu như tới VLưu huynh lắm lúc thi đấu khăm
Khi II thời điểm IV , VI tăng tột cùng
Clo Iot lung tung
II III V VII thường thì I thôi
Mangan rắc rối nhất đời
Đổi tự I đến VII thời bắt đầu yên
Hoá trị II dùng rất nhiều Hidro (H) cùng với liti (Li)Natri (Na) cùng với kali (K) chẳng rời
Ngoài ra còn bội nghĩa (Ag) sáng ngời
Chỉ mang hoá trị I thôi chớ nhầm
Riêng đồng (Cu) với thuỷ ngân (Hg)Thường II ít I chớ trù trừ gì
Đổi chũm II , IV là chì (Pb)Điển hình hoá trị của chì là IIBao giờ thuộc hoá trị IILà ôxi (O) , kẽm(Zn) chẳng sai chút gì
Ngoài ra còn tồn tại canxi (Ca)Magiê (Mg) với bari (Ba) một nhà
Bo (B) , nhôm (Al) thì hóa trị IIICacbon (Ca) Silic (Si) thiếc (Sn) là IV thôi
Thế nhưng phải nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ biến chuyển liền fe IIIPhốtpho III ít gặp gỡ mà
Photpho V chính tín đồ ta chạm mặt nhiều
Nitơ (N) hoá trị bao nhiêu ?
I , II, III , IV phần đông tới VLưu huynh lắm lúc chơi khăm
Khi II dịp IV , VI tăng tột cùng
Clo Iot lung tung
II III V VII thường xuyên thì I thô
Hoá trị VII cũng rất được yêu tốt cần
Bài ca hoá trị trực thuộc lòng
Viết thông phương pháp đề chống lãng quên
Học hành cố gắng cần chuyên
Siêng ôn chuyên luyện tất yếu nhớ nhiều
- những nguyên tố chất hóa học được sắp xếp theo quy biện pháp trong một bảng hotline là bảng tuần hoàn các nguyên tố chất hóa học (gọi tắt là bảng tuần hoàn)
- Bảng tuần hoàn bây chừ có 118 nguyên tố hóa học được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử

II. Kết cấu bảng tuần hoàn
Bảng tuần trả gồm các ô được bố trí thành những hàng và các cột
1. Ô nguyên tố
- mỗi nguyên tố chất hóa học được sắp xếp vào một trong những ô của bảng tuần hoàn, được gọi là ô nguyên tố
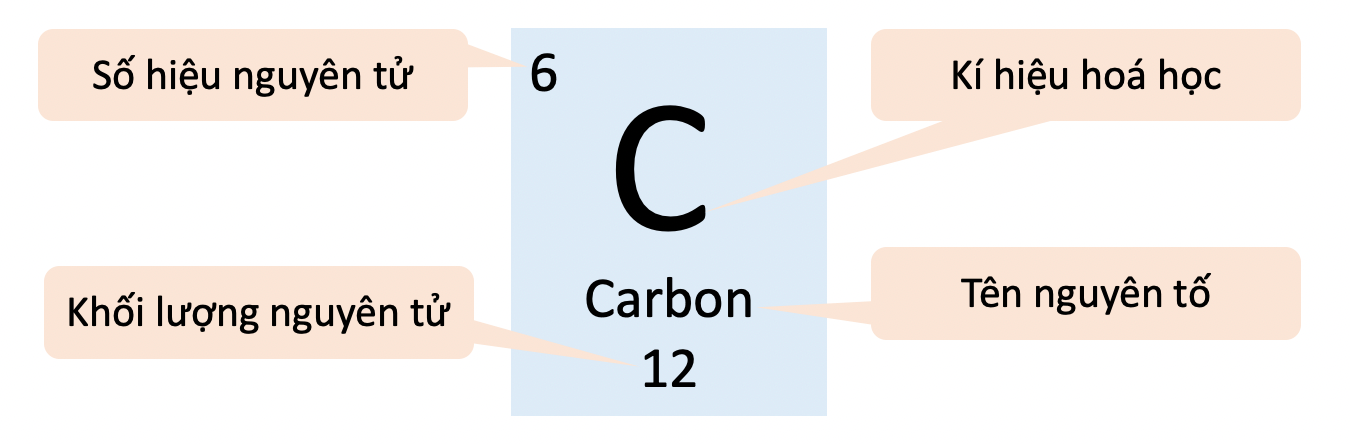
- Ô nguyên tố mang đến biết:
+ Số hiệu nguyên tử (Z)
+ Kí hiệu hóa học
+ thương hiệu nguyên tố
+ cân nặng nguyên tử
- Số hiệu nguyên tử (Z) bằng số đơn vị chức năng điện tích hạt nhân, và cũng là số sản phẩm công nghệ tự của yếu tắc trong bảng tuần hoàn
2. Chu kì
- Chu kì gồm các nguyên tố cơ mà nguyên tử của chúng có cùng số lớp electron với được thu xếp thành mặt hàng theo chiều tăng dần của điện tích hạt nhân

- Số trang bị tự của chu kì ngay số lớp electron trong nguyên tử của các nguyên tố vào chu kì đó
- Bảng tuần hoàn hiện này bao gồm 7 chu kì, được tiến công số từ là một đến 7
- Chu kì 1:
+ bao gồm 2 nhân tố (H cùng He)
+ Số lớp electron: 1
+ Điện tích phân tử nhân tăng tự H (+1) đến He (+2)
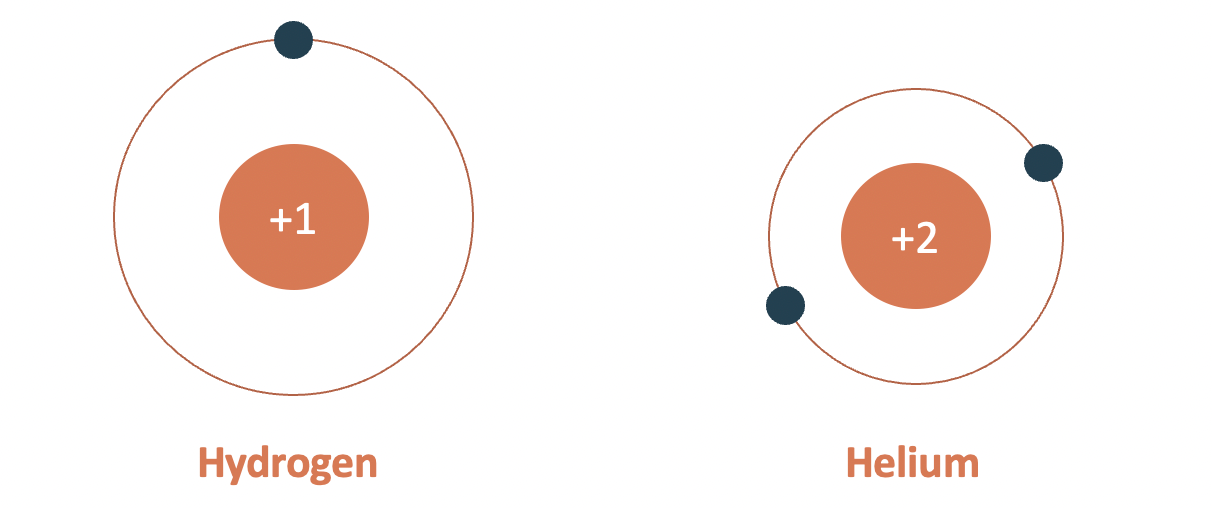
Mô hình cấu tạo nguyên tử hydrogen với helium
- Chu kì 2:
+ tất cả 8 yếu tắc (từ Li mang lại Ne)
+ Số lớp electron: 2
+ Điện tích hạt nhân tăng nhiều từ Li (+3) mang lại Ne (+10)

Mô hình cấu tạo nguyên tử lithium với neon
- Chu kì 3:
+ bao gồm 8 nhân tố (từ Na mang lại Ar)
+ Số lớp electron: 3
+ Điện tích phân tử nhân tăng từ mãng cầu (+11) cho Ar (+18)

Mô hình kết cấu nguyên tử sodium với argon
- trong một chu kì, lúc đi tự trái sang yêu cầu theo chiều tăng ngày một nhiều của năng lượng điện hạt nhân
+ bắt đầu chu kì là một kim loại điển hình (trừ chu kì 1)
+ Cuối chu kì là 1 trong những phi kim điển hình
+ ngừng chu kì là 1 trong những khí hiếm
Ví dụ: trong chu kì 3:
+ bắt đầu chu kì là yếu tắc sodium (Na), là một trong kim loại điển hình
+ Cuối chu kì là yếu tắc chlorine (Cl), là 1 phi kim điển hình
+ hoàn thành chu kì là yếu tắc khí thảng hoặc argon (Ar)
3. Nhóm
- team gồm các nguyên tố có đặc thù hóa học tương tự như nhau, được xếp thành cột theo chiều tăng mạnh của điện tích hạt nhân
- Bảng tuần hoàn gồm 18 cột, trong các số đó có 8 cột là team A và 10 cột là đội B.
- nhóm A được đánh số thứ tự bằng số La Mã lần lượt từ đội IA cho nhóm VIIIA.
- Số vật dụng tự của nhóm A bằng số electron phần bên ngoài cùng vào nguyên tử của nguyên tố thuộc nhóm đó.

- nhóm IA:
+ Gồm những nguyên tố kim loại chuyển động mạnh (kim một số loại điển hình) trừ hydrogen
+ Số electron lớp ngoài cùng: 1
+ Điện tích hạt nhân của nguyên tử kim loại tăng dần đều từ Li (+3) mang lại Fr (+87)
- team VIIA:
+ Gồm các nguyên tố phi kim hoặt động bạo phổi (phi kim điển hình) trừ tennesine
+ Số electron lớp bên ngoài cùng: 7
+ Điện tích hạt nhân của nguyên tử phi kim tăng dần đều từ F (+9) cho At (+85)
- đội VIIIA:
+ Gồm các nguyên tố khí hiếm
+ Số electron phần bên ngoài cùng: 8 (trừ helium)
+ Điện tích phân tử nhân tăng dần từ He (+2) đến Og (+118)
III. Vị trí của các nguyên tố kim loại, phi kim cùng khí hi hữu trong bảng tuần hoàn
- các nguyên tố chất hóa học được chia làm 3 loại: kim loại, phi kim cùng khí hiếm
a) Kim loại
- các nguyên tố sắt kẽm kim loại nằm nghỉ ngơi phía bên trái và góc dưới bên cần của bảng tuần hoàn
- những nguyên tố nhóm IA (trừ hydrogen) hầu hết là kim loại điển hình
b) Phi kim
- những nguyên tố phi kim nằm ở vị trí phía trên, bên cần của bảng tuần hoàn
- những nguyên tố nhóm VIIA phần đông đều là phi kim điển hình nổi bật (flourine là phi kim vận động mạnh nhất)









